Dans une décision historiquement embarrassante, la FDA est récemment devenue le seul organisme de réglementation international à autoriser l'utilisation de vaccins à ARNm de Moderna et Pfizer pour les enfants âgés de six mois à cinq ans.
Pour l'écrasante majorité des jeunes enfants et des tout-petits, il n'y a probablement aucune justification ou besoin d'une telle autorisation.
Ils courent un risque extrêmement faible de complications graves du COVID, ce qui signifie que le calcul du rapport risque-bénéfice est au mieux précaire, et potentiellement négatif au pire.
C'est aussi un témoignage de la politisation troublante réussie des agences de réglementation américaines que pratiquement aucun autre pays internationalement respecté n'importe où sur terre n'a pris cette décision déconcertante.
La Suède, par exemple, a arrêté le déploiement du vaccin Moderna pour toute personne de moins 30.
Pas 18. Pas 12. Pas 5. 30.
Les États-Unis vont maintenant vacciner des enfants dès l'âge de six mois avec le même produit que la Suède a interdit à toute personne de moins de 30 ans, citant des effets secondaires qui font pencher la balance des risques et des avantages.
Malgré cette divergence d'opinions préoccupante, le chef de cabinet de la Maison Blanche / président par intérim Ronald Klain a célébré l'annonce de manière confuse :
Fait intéressant, The New York Times Le lien que Klain a tweeté a soulevé un autre aspect préoccupant du processus d'autorisation, nécessitant un examen des documents et des déclarations antérieures de la FDA.
La première information intéressante du longue libération de la FDA est leur estimation de l'efficacité du vaccin pour les groupes plus âgés.
Les chiffres sont… sombres :
Les estimations observées de l'efficacité du vaccin contre la maladie symptomatique due au variant Omicron sont les suivantes : 8.8 % (IC à 95 %, 7.0 à 10.5) à 25 semaines ou plus depuis la primovaccination chez les adultes ; 59.5 % chez les adolescents de 12 à 15 ans 2 à 4 semaines après la dose 2, 16.6 % pendant le mois 2 après la deuxième dose et 9.6 % pendant le mois 3 après la deuxième dose
Efficacité de 8.8 % contre les maladies symptomatiques après environ 6 mois chez les adultes.
En seulement deux mois de vaccination, l'efficacité contre les maladies symptomatiques chez les 12 à 15 ans chute à 16.6 % et à 9.6 % au troisième mois. Ils ne précisent pas l'efficacité par la suite, probablement parce qu'elle tombe à zéro pour cent ou même devient négative.
De plus, leurs estimations de l'efficacité du vaccin contre les hospitalisations et les visites aux urgences sont considérablement inférieures aux taux de 95 à 100 % revendiqués par les « experts » qui ont été utilisés pour justifier la discrimination et les appels terrifiants pour exclure les « non vaccinés » des soins médicaux :
Les estimations observées de l'efficacité du vaccin à ARNm de la série primaire contre les hospitalisations dues à la variante Omicron chez les adultes ont été rapportées à 41%-57% à 6-9 mois ou plus après la deuxième dose.
Dans une étude observationnelle menée auprès d'adolescents âgés de 12 à 18 ans (intervalle médian depuis la vaccination, 162 jours) pendant la période prédominante d'Omicron, l'efficacité du vaccin de la série primaire était de 40 % (IC à 95 %, 9 à 60) contre l'hospitalisation pour COVID-19
Les estimations observées de l'efficacité du vaccin à ARNm de la série primaire contre les visites aux services d'urgence/de soins urgents dues à la variante Omicron chez les adultes ont été rapportées entre 31 % et 38 % à 6-9 mois ou plus après la deuxième dose.
Quel que soit le pourcentage d'efficacité revendiqué avant Omicron, ces pourcentages sont fortement diminués par rapport aux attentes.
Aussi bas que 41 % pour l'efficacité du vaccin contre l'hospitalisation des adultes de 6 à 9 mois ou plus après la deuxième dose.
Service d'urgence ou soins d'urgence aussi bas que 31 %. 40 % avec un intervalle de confiance de 9 à 60 % pour les adolescents de 12 à 18 ans.
C'est encore une autre raison pour laquelle les mandats basés sur la vaccination sont totalement indéfendables :
Ces chiffres sont remarquablement bas et échoueraient objectif initial de 50 % que la FDA a fixé pour l'autorisation d'urgence des vaccins COVID.
Vous souvenez-vous de la partie préoccupante que j'ai mentionnée plus tôt à propos du processus pour les jeunes enfants ?
Non seulement les pourcentages d'efficacité n'atteignent pas leur seuil de 50% chez les adultes, mais pour les enfants, ils ont tout simplement rejeté cette norme.
Afin d'autoriser le vaccin pour les groupes d'âge plus jeunes, la FDA a imputé l'efficacité du vaccin par "immunobridging" et en comparant la génération d'anticorps des groupes d'âge plus âgés :
L'efficacité du vaccin a été déduite par pontage immunologique sur la base d'une comparaison des paramètres d'immunogénicité (concentrations moyennes géométriques des anticorps neutralisants du SRAS-CoV-2 (GMT) et taux de séroréponse 1 mois après la dose 3) entre les participants âgés de 6 à 23 mois de l'étude C4591007 (n = 146) et participants âgés de 16 à 25 ans de l'étude C4591001
Essentiellement, même si la création d'anticorps n'est clairement pas suffisante pour prévenir une infection symptomatique ou atteindre les estimations initiales de 95 %, la FDA a déduit l'efficacité de la vaccination chez les bébés et les tout-petits sur la base de comparaisons de la génération d'anticorps.
À ce stade, il est déjà évident que les États-Unis seront le seul pays occidental à commencer les vaccinations par ARNm pour les enfants aussi jeunes.
La pression politique exercée par le président par intérim Klain, des militants comme Ashish Jha, Jeremy Faust, Jerome Adams et d'autres est indéniablement dangereuse.
Cela pourrait potentiellement expliquer pourquoi la FDA a changé l'objectif de 50% d'efficacité à la génération d'anticorps - pour se soumettre à la pression politique de la Maison Blanche et de leurs alliés dans les médias et la communauté «d'experts».
Le mois dernier, Vinay Prasad a détaillé l'absurdité de cette décision :
Il mentionne également que l'objectif de 50% initialement déterminé était "arbitraire" et assez bas.
L'efficacité des vaccinations contre l'hospitalisation à l'ère Omicron pour ceux qui sont "entièrement vaccinés" est baisser que cela, et ils ont déduit l'efficacité chez les jeunes enfants sur la base de la génération d'anticorps dans ces mêmes groupes d'âge.
En bref, ils ont rejeté leur cible déterminée arbitrairement, qui était déjà faible, puis ont imputé une efficacité basée sur un point final (génération d'anticorps) qui, nous l'avons déjà vu, ne fonctionne pas particulièrement bien contre la variante dominante actuelle.
Alors bien sûr, c'est extrêmement déconcertant et frustrant, mais bon, au moins Ron Klain est content.
Immunité naturelle
La FDA, dans son infinie sagesse, a également ignoré les propres estimations du CDC, qui indiquent que 75 % des enfants ont déjà eu le COVID :

Bien sûr, personne impliqué dans ce processus de prise de décision n'est prêt à reconnaître que 75% des enfants ont été infectés par le COVID malgré le masquage, les fermetures d'écoles et d'autres «interventions» conçues pour empêcher ou «ralentir» la propagation du virus. Mais je m'égare.
L'immunité naturelle est probablement plus protectrice contre une infection future que la vaccination, comme l'explique ce tweet de Tracy Høeg sur la base des données d'une étude du New England Journal of Medicine :
La FDA s'est précipitée pour autoriser les vaccins pour les très jeunes enfants sur la base de la réponse des anticorps au lieu des estimations d'efficacité tout en ignorant que 75% des jeunes enfants avaient déjà une meilleure protection.
C'est une clinique de ce qu'il ne faut pas faire.
Estimations de l'efficacité réelle
La FDA a généré des estimations de l'efficacité du vaccin pour les âges de 6 à 23 mois et de 2 à 4 ans et les chiffres auxquels ils sont arrivés montrent pourquoi ils ont dû recourir à la réponse des anticorps au lieu d'une réduction prouvée réelle.
Participants âgés de 6 à 23 mois
Une analyse descriptive préliminaire de l'efficacité des cas de COVID-19 survenus au moins 7 jours après la dose 3 parmi les participants âgés de 6 à 23 mois dans la population d'efficacité évaluable de la dose 3 comprenait un total de 3 cas confirmés accumulés chez les participants avec et sans preuve d'antériorité. Infection par le SRAS-CoV-2 jusqu'à la date limite des données du 29 avril 2022. La population d'efficacité évaluable de la dose 3 comprenait 376 participants randomisés pour recevoir BNT162b2 et 179 participants randomisés pour recevoir un placebo. L'estimation de l'EV dans cette analyse préliminaire était de 75.6 % (IC à 95 % : -369.1 %, 99.6 %), avec 1 cas de COVID-19 dans le groupe BNT162b2 contre 2 dans le groupe placebo (randomisation 2:1 BNT162b2 contre placebo).
Emphase ajoutée
Il y a eu 1 cas dans le groupe vaccin et 2 dans le groupe placebo. C'est ça.
C'est ainsi que vous obtenez des intervalles de confiance de -369.1 % à 99.6 %. Le vaccin pourrait avoir une efficacité négative de près de 400 % pour les bébés, ou il pourrait être l'un des meilleurs vaccins jamais créés avec une efficacité presque parfaite. Qui sait! Certainement pas la FDA sur la base de 3 cas au total de COVID dans ce groupe d'âge.
Mais ne vous inquiétez pas, ils ont collecté beaucoup plus de données pour le groupe d'âge 2-4 ans.
Cet ensemble de données contenait 7 cas au total :
Participants de 2 à 4 ans
Une analyse descriptive préliminaire de l'efficacité des cas de COVID-19 survenus au moins 7 jours après la dose 3 parmi les participants âgés de 2 à 4 ans dans la population d'efficacité évaluable de la dose 3 comprenait un total de 7 cas confirmés accumulés chez les participants avec ou sans preuve d'antériorité.
Infection par le SRAS-CoV-2 jusqu'à la date limite des données du 29 avril 2022. La population d'efficacité évaluable à la dose 3 avec et sans preuve d'infection antérieure par le SRAS-CoV-2 comprenait 589 participants randomisés pour recevoir BNT162b2 et 271 participants randomisés pour recevoir un placebo. L'estimation de l'EV dans cette analyse préliminaire était de 82.4 % (IC à 95 % : -7.6 %, 98.3 %), avec 2 cas de COVID-19 dans le groupe BNT162b2 contre 5 dans le groupe placebo (randomisation 2:1 BNT162b2 contre placebo). Un cas confirmé dans le groupe placebo s'est produit chez un participant présentant des signes d'infection par le SRAS-CoV-2 avant 7 jours après la dose 3.
Eh bien, au moins, nous sommes tombés sur une possible efficacité négative de 8 % dans les intervalles de confiance !
Mais encore une fois, ne vous inquiétez pas, la FDA est consciente de cette limitation, et bien d'autres encore :
Dans une analyse combinée des deux groupes d'âge, l'EV était de 80.4 % (IC à 95 % : 14.1 %, 96.7 %) avec 3 cas dans le groupe BNT162b2 et 7 cas dans le groupe placebo. L'interprétation des données d'efficacité post-dose 3 pour les deux groupes d'âge, et pour le groupe d'âge de 6 mois à 4 ans en général, est limitée pour les raisons suivantes :
- L'efficacité du vaccin après la dose 3 ne peut pas être estimée avec précision en raison du nombre limité de cas accumulés pendant le suivi en aveugle, comme en témoignent les larges intervalles de confiance associés aux estimations.
- Ces données descriptives d'efficacité sont préliminaires, le protocole précisant 21 cas non encore atteints.
- Il y avait des intervalles de dosage très variables entre les doses 2 et 3, avec des intervalles médians de 112 (intervalle de 56 à 245) jours chez les participants âgés de 6 à 23 mois et de 77 (intervalle de 42 à 239) jours chez les participants âgés de 2 à 4 ans dans la population d'efficacité évaluable à la dose 3.
- La durée médiane de suivi en aveugle après la dose 3 dans les analyses n'était que de 35 jours pour les participants âgés de 6 à 23 mois et de 40 jours pour les participants âgés de 2 à 4 ans.
Le protocole précisait 21 cas non atteints. Mais ils ont quand même autorisé les vaccins !
Parmi le groupe d'âge de 2 à 4 ans, il y avait un taux significativement plus élevé de cas « répondant aux critères de la COVID-19 sévère » dans le groupe qui a reçu le vaccin :
Sept cas chez des participants âgés de 2 à 4 ans répondaient aux critères de COVID-19 sévère : 6 dans le groupe BNT162b2, dont 2 cas survenus après la levée de l'aveugle, et 1 dans le groupe placebo.
Cela ne signifie pas que ceux qui se font vacciner PLUS susceptibles d'avoir un cas grave de COVID, mais cela souligne une fois de plus le problème de la si petite taille des échantillons et de l'abandon des cibles initiales.
Et il convient de noter que les cas graves ont été déterminés comme n'étant pas « cliniquement significatifs » :
Tous ces éléments ont été considérés par l'investigateur comme non significatifs sur le plan clinique sur la base de l'examen lors de la visite médicale et des circonstances contributives telles que le participant pleurant pendant l'examen
Les tableaux de données
La FDA sait que la plupart des Américains ne consulteront jamais les tableaux de données, en particulier ceux de la classe des médias et des « experts » activistes de Twitter.
Mais quiconque les examine peut immédiatement comprendre l'absurdité du processus décisionnel de la FDA :
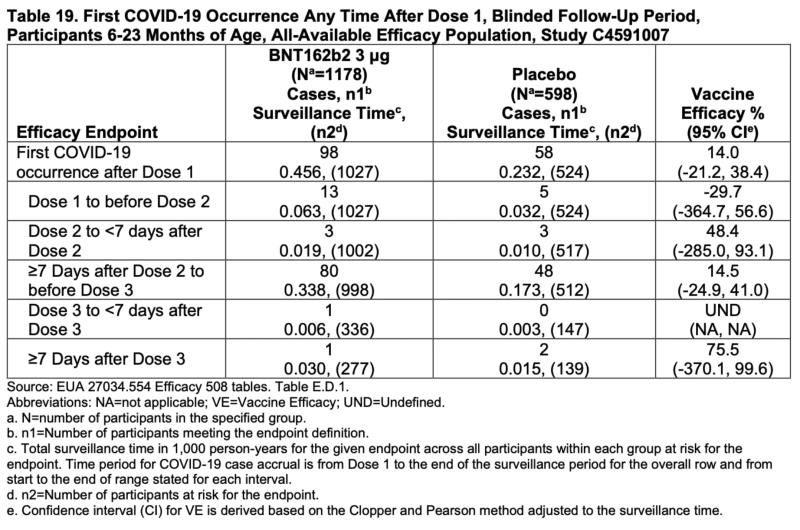
Les intervalles de confiance pour chaque calcul d'efficacité pour les participants de 6 à 23 mois tombent en dessous de zéro. Chacun.
L'estimation globale est de 14% et même cela pourrait être aussi bas que -21.2%.
C'est juste risible. Eh bien, ce serait risible si ce n'était pas une décision aussi importante.
Si vous voulez être caritatif, au moins le pourcentage d'efficacité global pour les personnes âgées de 2 à moins de 5 ans n'avait pas d'intervalles de confiance négatifs :
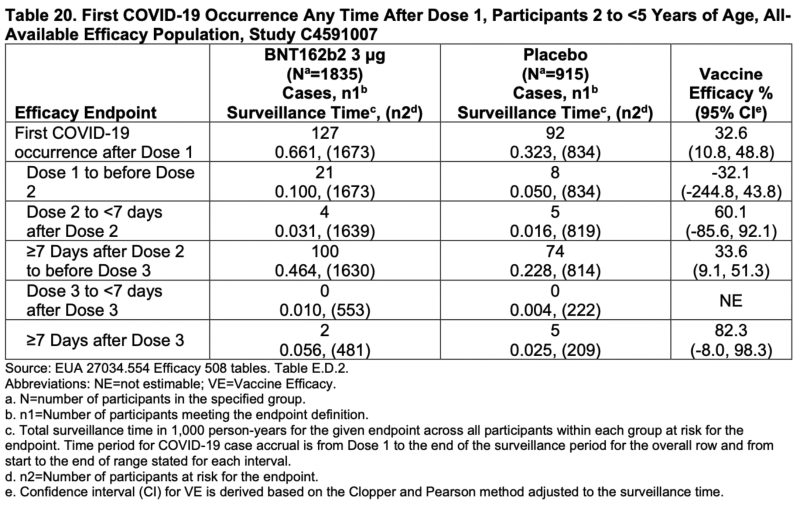
Bien que trois des quatre principaux critères d'évaluation aient des intervalles de confiance négatifs, cela nécessite toujours une quantité importante de charité.
Il convient également de noter que la période de temps entre l'administration de la dose 1 et de la dose 2 était associée à une efficacité négative dans les deux groupes d'âge.
Cela a probablement contribué aux problèmes de communication des données lors du calcul de l'efficacité du vaccin dans le monde réel. Tout cas survenant au cours de cette période est considéré comme "non vacciné", sauf dans ces groupes d'âge, c'est-à-dire lorsque l'efficacité est à son point le plus bas.
Le fait que la FDA ait autorisé ces vaccins pour les enfants sur la base de ces données est tout simplement inexcusable.
La taille des échantillons ne respectait pas leur protocole spécifié 21 cas.
Les calculs d'efficacité des vaccins, même en excluant les gigantesques intervalles de confiance, étaient bien en deçà de l'objectif arbitraire de 50 % qu'ils ont créé pour l'autorisation d'utilisation d'urgence chez les adultes.
L'inclusion des intervalles de confiance montre la possibilité d'une efficacité négative, ce qui, bien que peu probable, est toujours possible compte tenu du nombre extraordinairement faible de cas dans les groupes vaccin et placebo.
Ils ont simplement utilisé «l'immunopontage» pour déduire une protection basée sur la génération d'anticorps, au lieu de taux d'efficacité prédéterminés.
C'est encore un autre indicateur terrifiant de la motivation politique de la FDA et de la façon dont l'activisme a déformé l'honnêteté intellectuelle.
Les "experts" sont si désespérés de maintenir leur réputation et d'éviter d'être qualifiés d'"anti-vaxxer" par des influenceurs comme Eric Feigl-Ding, Angela Rasmussen et d'autres qu'ils semblent peu disposés à dénoncer les failles du processus de prise de décision.
Il est à la fois difficile et facile de croire que c'était tout ce qu'il fallait pour justifier une vaccination « d'urgence » pour les tranches d'âge à très faible risque de maladie grave.
Cette décision sera à juste titre une raison supplémentaire de l'érosion croissante de la confiance dans les supposés «experts» de la santé publique, un embarras pour les régulateurs américains capturés par la politique.
Publié sous un Licence internationale Creative Commons Attribution 4.0
Pour les réimpressions, veuillez rétablir le lien canonique vers l'original Institut Brownstone Article et auteur.










