Cette semaine, la Food and Drug Administration (FDA) des États-Unis autorisé l'utilisation d'un rappel unique du vaccin covid-19 de Pfizer chez les enfants âgés de 5 à 11 ans, au moins cinq mois après la fin d'une série primaire de vaccinations. Le comité consultatif du CDC devrait approuver la décision aujourd'hui.
Selon la FDA, les preuves sous-jacentes à sa décision provenaient d'un sous-ensemble de 67 enfants qui faisaient partie d'un essai en cours et qui ont été boostés 7 à 9 mois après leur première série. Ils ont montré des niveaux d'anticorps plus élevés un mois après le rappel par rapport à avant le rappel.
La décision de la FDA est audacieuse pour plusieurs raisons.
Manque de données
Juste au moment où la FDA devrait exiger de meilleures données, l'agence abaisse ses normes.
Aucune étude rigoureuse dans ce groupe d'âge n'a montré qu'une troisième dose peut réduire des résultats importants tels que les hospitalisations et les décès - les essais cliniques randomisés n'ont pas été réalisés, bien que Pfizer gagne des milliards de dollars de revenus.
Au lieu de cela, la décision était basée sur la présence d '«anticorps neutralisants» car ils sont faciles à mesurer et à étudier. Non seulement les niveaux d'anticorps diminuent rapidement, mais ils ne sont pas nécessairement corrélés à la protection.
Le propre de la FDA site dit que "les tests d'anticorps ne doivent pas être utilisés pour évaluer le niveau d'immunité ou de protection d'une personne contre le covid-19". Et pourtant, c'est ce que l'agence a fait.
Cela fait suite aux précédents données de New York lors de la poussée d'omicron montrant que l'efficacité du vaccin de Pfizer chez les 5-11 ans a chuté de 68% à la mi-décembre 2021, à seulement 12% en janvier 2022, bien en dessous du seuil initial de 50% de la FDA.
L'accent myope sur les anticorps par les régulateurs des médicaments et les autorités sanitaires s'est fait au détriment de la prise en compte d'autres aspects importants du système immunitaire tels que les lymphocytes T CD4 + et les réponses tueuses naturelles, qui jouent un rôle crucial dans la prévention des infections et sont considérées comme plus durable que les anticorps. Malheureusement, ces données ont été largement ignorées par les autorités.
Le Dr Peter Marks, directeur du Center for Biologics Evaluation and Research de la FDA, a reconnu que les données montrent de plus en plus que la protection après deux doses diminue avec le temps et qu'une troisième injection pourrait aider à renforcer la protection des enfants de 5 à 11 ans, car les « avantages l'emportent sur les risques ».
Cependant, en termes de sécurité, la FDA n'a évalué qu'environ 400 enfants ayant reçu une dose de rappel et tout préjudice grave et rare ne serait pas détecté dans un échantillon aussi petit.
Ignorer l'immunité naturelle
En autorisant une troisième dose pour tous les enfants de 5 à 11 ans - dont la plupart ont déjà une immunité naturelle - il est peu probable qu'ils apportent un bénéfice supplémentaire et peuvent les exposer à des dommages inutiles.
Le CDC américain rapporté qu'environ 75% des enfants et des adolescents ont des preuves sérologiques (anticorps) d'une infection antérieure, et par conséquent, ont déjà développé une protection robuste et durable contre le covid-19.
Le gouvernement britannique estimé que plus de 85 % des enfants âgés de 5 à 11 ans avaient contracté le covid-19 en janvier 2022 et que leur immunité naturelle acquise fournirait une protection contre une maladie grave ou une réinfection future.
Marty Makary, professeur à la Johns Hopkins School of Medicine écrit dans le Wall Street Journal que l'immunité naturelle est susceptible d'être très robuste chez les enfants compte tenu de leur système immunitaire plus fort. Il a dit que si un enfant avait déjà eu le covid-19, "il n'y aurait aucune base scientifique pour la vaccination".
Il a également observé qu'aucun cas de covid-19 n'a été documenté ni dans le groupe vacciné ni dans le groupe placebo chez les enfants qui avaient déjà été infectés par le SRAS-CoV-2 lors de l'essai de Pfizer, renforçant le bénéfice de l'immunité naturelle.
Comité consultatif
Le comité consultatif sur les vaccins et les produits biologiques apparentés (VRBPAC) fournit non seulement des informations et une expertise à l'agence, mais il confère également crédibilité et fiabilité au processus décisionnel de la FDA.
Cependant, la FDA n'a pas convoqué son groupe consultatif cette semaine, affirmant qu'elle avait déjà discuté des rappels lors d'une réunion précédente et que de nouvelles discussions ne seraient d'aucune utilité.
Certains membres ont fait part de leurs inquiétudes quant au fait que l'organisme de réglementation des médicaments a pris à plusieurs reprises des décisions sur les doses de rappel sans tenir de discussions publiques ouvertes et affirment que l'agence s'appuie de moins en moins sur ses experts indépendants pour obtenir des conseils avant d'approuver les médicaments.
Dans un analyse récente, les chercheurs ont montré que seuls 6 % des médicaments approuvés par la FDA ont été examinés par des comités consultatifs en 2021, contre 55 % en 2010 (voir figure).
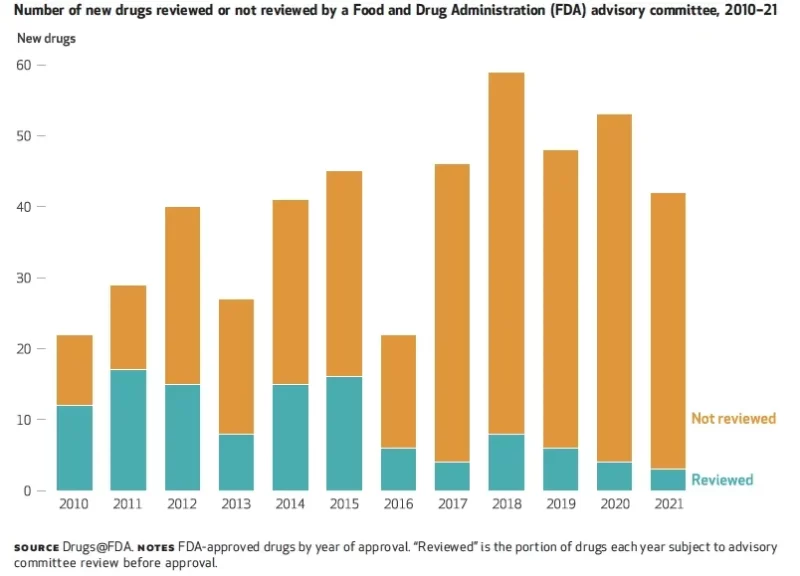
Si la confiance du public reflète ces chiffres, les organismes de réglementation ont encore un long chemin à parcourir pour regagner la confiance dans leurs processus décisionnels.
Absorption ?
Malgré l'expansion continue des rappels, l'enthousiasme pour les vaccins semble décliner. Les vaccins covid-19 ne sont pas aussi efficaces pour prévenir l'infection et la transmission qu'on l'espérait initialement, et avec un si petit risque de maladie grave chez les enfants, les parents sont de moins en moins convaincus.
A récente enquête américaine a constaté que près d'un tiers des parents d'enfants de moins de 5 ans ont déclaré qu'ils ne feraient "certainement pas" faire vacciner leur enfant en premier lieu, 11 % supplémentaires ont déclaré qu'ils ne le feraient que si nécessaire (obligatoire) et 38 % prévoyaient d'attendre dans l'ordre pour voir comment le vaccin a fonctionné pour les autres.
Pfizer n'a pas encore soumis sa demande à la FDA concernant un vaccin à trois doses pour les enfants de moins de 5 ans, mais il devrait le faire dans les semaines à venir.
Publié à l'origine sur le auteurs site
Publié sous un Licence internationale Creative Commons Attribution 4.0
Pour les réimpressions, veuillez rétablir le lien canonique vers l'original Institut Brownstone Article et auteur.









