Depuis le début de la pandémie, on nous a assuré que le respect du masquage communautaire résoudrait nos problèmes et arrêterait la propagation du SARS-CoV-2. Pourtant, les données d'application du monde réel ont constamment montré qu'elles échouaient en tant que mesure d'atténuation pour la protection personnelle, et au lieu de corriger le cap sur les conseils aléatoires qui ont été distribués, on nous a dit de masque Plus fort avec des appareils de plus en plus restrictifs, quoique effectivement non atténuants.
Mais why ont-ils échoué, et pourquoi continuent-ils d'échouer ? Ci-dessous, nous expliquons en détail pourquoi, même en supposant une capacité de capture parfaite hypothétique, les N95 ne parviennent pas à atténuer la propagation du SRAS-CoV-2.
Nous devrions commencer par considérer la transmissibilité virale et la production de matières infectieuses comme des spectres, basés sur la gravité de la maladie, la réponse immunitaire d'un individu donné et les progrès au cours de la maladie. Ceux-ci se sont tous avérés avoir des impacts significatifs sur la charge virale d'un individu infecté par le SRAS-CoV-2. Nous discuterons des chiffres de production par rapport aux taux d'infectiosité et des méthodes de mesure de la dose infectieuse minimale.
Ce sont chacun des facteurs importants à prendre en compte dans l'atténuation des agents pathogènes, même indépendamment, mais combinés, ils peuvent nous montrer spécifiquement si une approche donnée aura un résultat souhaité dans l'élimination d'un danger infectieux. Les chiffres de sortie des émissions respiratoires montrent la quantité de matière expulsée par un individu et si elles sont transmissibles ou non avec un agent pathogène respiratoire, mais les chiffres de sortie varient considérablement entre les stades les plus graves d'apparition de la maladie, les périodes de récupération et lorsque la PCR est négative. pour un pathogène donné.
En comparant la sortie avec les rapports particule/unité formant plaque (PFU), on nous donne un taux de combien de particules émises sont des virions viables capables de provoquer une infection. Chacune de ces unités infectieuses est appelée PFU. Le nombre de PFU devant être reçues par un hôte potentiel est donné sous la forme d'un chiffre de dose infectieuse minimale (MID), qui est un seuil qui, une fois atteint, l'apparition de l'infection doit être anticipée.
En examinant les chiffres du rapport particules/PFU et en calculant le potentiel MID, le produit final est le nombre potentiel d'individus pouvant être infectés sur une période de temps donnée.
Avec ce seuil MID pour le potentiel d'infectiosité, nous pouvons ensuite appliquer la capacité de capture parfaite hypothétique d'un appareil donné pour voir si le meilleur scénario entraîne la probabilité que l'appareil atténue ou empêche le seuil MID d'être atteint pour le danger.
Ici, nous examinons la sortie, le rapport particule sur PFU et le MID pour le SRAS-CoV-2, par rapport à la capacité de capture parfaite hypothétique des N95, pour démontrer que même avec un taux de capture parfait (et dans ce cas, de matière beaucoup plus petite que ce que l'appareil est approuvé ou conçu pour capturer), les 5 % jamais capturés représentent toujours une exposition potentielle suffisamment abondante à des matières infectieuses pour entraîner une infection.
Gammes de particules et comportement correspondant de la matière émise
Les mesures d'atténuation de la pandémie auraient dû commencer avec une taille de particule minimale viable, qui pour le SRAS-CoV-2 tombe à 0.06-0.14 µm. Bien que fréquemment poussés par les responsables de la santé publique, les N95 sont uniquement évalués et approuvés pour capturer la matière supérieure à 0.3 µm. Il a été démontré que plus de 90 % des particules expirées tombent sous 0.3 µm. Cette taille de matière reste en l'air pendant de longues périodes - des heures, voire des jours, selon les taux d'échange d'air dans l'espace donné. Il a été démontré que le SRAS-CoV-2 reste viable après des heures sous forme d'aérosol à l'extérieur d'un hôte et pendant des jours sur des surfaces.
"Le SARS-CoV-2 on a constaté que le virus était viable pendant 3h. dans les aérosols, avec diminution de la concentration du virus infectieux de 103.5 - 102.7 TCID50 par litre d'air.
Cette étude a utilisé des aérosols générés en laboratoire contenant le SRAS-CoV-2 infectieux et a observé la viabilité des matières émises sur différentes surfaces et sous forme d'aérosols au fil du temps.
Lorsque l'on considère ce qui suit, on se demande également si les membranes poreuses du masque et du respirateur ont joué un rôle dans l'augmentation du terme de viabilité de la matière virale :
"Les temps de survie des virus en suspension dans l'air sur les surfaces diffèrent en fonction de si les surfaces sont non poreuses (par exemple, plastique, acier inoxydable, verre) ou poreuses (par exemple, papiers et vêtements). Les surfaces non poreuses sont des contributeurs majeurs à la transmission des maladies, car il a été observé que les temps de survie des virus en suspension dans l'air sont beaucoup plus longs que ceux des surfaces poreuses.
Les masques et les respirateurs comptent certainement comme des surfaces poreuses. De nombreux respirateurs sont également construits en plastique soufflé à l'état fondu. La viabilité virale sur les membranes des masques a-t-elle été suffisamment étudiée ?
Les taux de viabilité des aérosols sont importants car ils démontrent la capacité de transmission dans des espaces clos sans la présence d'un individu transmissible. Avec un individu transmissible présent et émettant dans l'espace donné, la sortie serait une matière virale constante et viable augmenterait la saturation atmosphérique de l'agent pathogène sur une base par respiration.
Un problème négligé mais critique avec les masques et les respirateurs est le joint - de petites zones d'espacement rendent ces appareils inefficaces pour le porteur. Il est rare, voire jamais, que quelqu'un porte ces appareils correctement, dans les conditions d'usure nécessaires, de sorte que nous rencontrons des appareils déjà non atténuants qui sont portés de manière incorrecte.
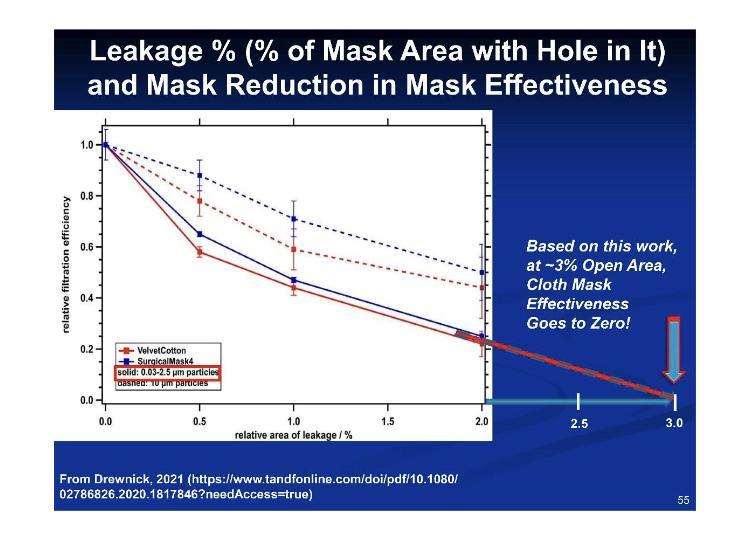
Selon ces chiffres pour l'ajustement par rapport aux fuites, 3.2 % de fuite équivaut à 100 % d'inefficacité.
Ce sont tous des facteurs qui doivent être pris en compte lorsqu'on s'attaque à la cause de l'échec d'un appareil à atténuer un danger donné. En examinant ensuite la production d'émissions, la dose minimale infectieuse, les unités de formation de plaque et leur relation, nous pouvons mieux comprendre pourquoi les contrôles techniques ont toujours été la bonne réponse, et non la mise en œuvre massive d'appareils de protection respiratoire.
Émissions respiratoires des patients « malades » – Résultats des tests PCR positifs contre négatifs :
Dans la recherche sur la production d'aérosols chez des sujets de test positifs pour la PCR en bonne santé par rapport au SRAS-CoV-2, 90% + pour cent des particules émises par les sujets de test positifs pour la PCR étaient inférieures à 0.3 µm, et des comptages de matière émise ont été effectués en comparant des individus avec différentes sévérités de maladie avec des sujets PCR-négatifs.
"La médiane expiré le nombre de particules était très significativement élevé chez les patients positifs à la PCR pour le SRAS-CoV-2 (1490.5 46.0/L [34,772.0–252.0 0.0/L]) par rapport aux témoins sains (882.0/L [0.0001–XNUMX/L] ; p < XNUMX. »
Si nous utilisons un taux d'émission respiratoire de 4.3 à 29 litres par minute (du manuel des facteurs d'exposition de l'EPA), la plage positive de PCR la plus élevée de 34,772 29 particules par litre multipliées par 1,008,388 litres par minute est aussi élevée que XNUMX XNUMX XNUMX particules émises par minute .
Bien que je n'affirme pas que toutes ces particules étaient des particules virales individuelles, ou des particules virales viables d'ailleurs, il existe néanmoins une différence très significative dans la matière émise par les individus positifs et négatifs à la PCR (valeurs médianes de 1,490.5 252 contre XNUMX). Un rapport de conversion des particules en PFU sera introduit après que le rôle des PFU aura été discuté.
Tailles des particules et taux d'émission :
L'étude a précédemment discuté des mesures - des plages de taille des particules émises chez les sujets positifs et négatifs au SRAS-CoV-2.
"Concernant la particule distribution de taille, les canaux de taille disponibles (au total, 14 canaux de taille de 0.15, 5.0 à 0.3, 0.3 μm) ont été analysés dans trois bandes de taille: <0.5, 0.5 μm, 5.0, 90–2, 78 μm et> 0.3, 0.3–XNUMX, XNUMX μm. Pour les deux groupes, la majorité des aérosols (> XNUMX % dans le groupe SARS-CoV-XNUMX PCR-positif et> XNUMX % dans le groupe -négatif) ont été trouvés dans la plus petite plage (<XNUMX μm). Surtout pour le groupe COVID-positif, les augmentations de la concentration totale d'aérosols ont été dominées par des augmentations de particules ≤ XNUMX μm.
Dix personnes parmi les 64 patients hospitalisés échantillonnés, qui figuraient parmi les cas les plus graves présentés, étaient responsables d'environ 64.8% du nombre de particules expirées, il est donc important dans ce cas d'examiner au la plage de sortie conservatrice et le potentiel d'infectiosité lors de l'exécution des calculs de sortie et de dose infectieuse minimale. Plus précisément, le journal indiquait :
"Dans le SRAS-CoV-2 Dans le groupe positif à la PCR, 15.6 % (n = 10/64) ont montré des comptages élevés et étaient responsables de 64.8 % de tous les comptages de particules expirées dans le groupe. De plus, les 15.6 %, soit 3.5 % de tous les patients (n = 10/288), étaient responsables de 51.2 % de toutes les particules expirées. »
Si nous comparons ceux qui connaissent la plus grande gravité de la maladie avec les taux d'infectiosité, nous pouvons en savoir plus sur la production de particules viables par les individus transmissibles. Compte tenu de la faible production de matière émise et de virions par les sujets de test PCR négatifs et positifs en récupération, il peut être prudent de supposer que cela indique que la faible probabilité que la transmission asymptomatique soit un facteur majeur de propagation virale.
La présence de copies d'ARN par rapport aux concentrations de virions viables
Toutes les copies d'ARN ou particules virales ne sont pas capables de former des PFU entraînant une réplication virale. Bien que des données aient été fournies sur le nombre d'unités infectieuses générées, il s'agit ne sauraient le taux de sortie des émissions. Il s'agit d'estimations de la production virale totale au cours d'une infection.
"Diviser par des estimations pour l'inverse du taux de clairance virale donne une production totale estimée de 3 × 109 à 3 × 1012 virions, soit 3 × 105 à 3 × 108 unités infectieuses tout au long de l'évolution d'une infection caractéristique.
En termes simplifiés, cela représente une production totale de 3 milliards à 3 billions de particules virales, soit 300,000 300 à XNUMX millions d'unités infectieuses générées au cours de la maladie.
Sortie de virions
Il existe différentes méthodes d'établissement de la production de virions, qui offrent des plages légèrement différentes lorsqu'elles sont vues côte à côte. Certaines études montrent des virions totaux émis, comme les suivants :
"Certains patients ont des titres viraux qui dépassent le titre moyen de Wölfel et al de plus de deux ordres de grandeur, augmentant ainsi le nombre de virions dans les gouttelettes émises à bien plus de 100,000 XNUMX par minute de parole.
D'autres études donnent le nombre total de particules et reposent sur l'utilisation de facteurs de conversion de la production totale en virions viables. Ce qu'il est important d'établir, c'est que la production globale de particules virales n'est pas égale au total des virions viables, c'est-à-dire des virions capables de créer des unités formant plaque (PFU).
PFU - Comprendre les particules virales nécessaires pour former des unités individuelles de formation de plaque (PFU):
Bien que tous les ARN viraux et particules virales émis ne soient pas capables de réplication virale et de création de PFU, il est entendu que chaque PFU est créé par une particule virale viable. Les extraits suivants discutent de l'impact des PFU sur les infections virales et leur apparition.
"Le dosage est conçu de sorte que chaque plaque résulte d'une infection en multipliant une seule particule virale infectieuse. En tant que tel, PFU/ml est considéré comme une mesure du nombre d'unités infectieuses par millilitre (UI/ml), avec la mise en garde que l'on ne peut pas être certain d'un rapport de un à un entre les plaques et les particules infectieuses dans l'aliquot appliqué. ”
"Pour la plupart des virus animaux, une particule infectieuse suffit pour initier l'infection.
"Le caractère linéaire de la courbe dose-réponse indique qu'un seul virion est capable d'initier une infection. Cependant, le rapport particule/pfu élevé de nombreux virus montre que tous les virions ne réussissent pas. Un rapport particule/pfu élevé est parfois causé par la présence de particules non infectieuses avec des génomes qui abritent des mutations mortelles ou qui ont été endommagés pendant la croissance ou la purification.
"On suppose généralement qu'une plaque est le résultat de l'infection de la cellule par un seul virion. Si tel est le cas, alors tous les virus produits à partir du virus de la plaque devraient être un clone, c'est-à-dire qu'ils devraient être génétiquement identiques.

Pour résumer, une particule virale viable, ou virion, est capable de créer une PFU, dans laquelle cette particule virale se réplique. Une partie de la matière créée est uniquement de l'ARN viral incapable de provoquer indépendamment une infection, et une partie de la matière créée est capable de se répliquer et d'infecter.
La relation entre la production totale de particules et la création de PFU s'appellent un rapport particule sur PFU. Pour le SARS-CoV-2, le rapport des particules émises aux PFU est de 1000 1,000,000 à XNUMX XNUMX XNUMX.
Études sur les PFU et les doses minimales infectieuses
Notre rythme respiratoire varie selon l'âge et le niveau d'activité. La fréquence respiratoire humaine moyenne est de 16 à 20 respirations par minute. Aux fins de cette discussion, un rythme respiratoire de 4.3 à 29 litres par minute (tiré du manuel des facteurs d'exposition de l'EPA) sera utilisé. Cette référence donne une autonomie allant jusqu'à 53 litres par minute. Nous examinerons la production sous forme de virions par minute et la dose infectieuse minimale sous forme de PFU et de virions pour la transmission, car les deux sont explorés dans les recherches disponibles.
Données sur la dose infectieuse minimale (MID) tirées de la littérature :
Des études comparatives de différents virus respiratoires et des études animales sur le SRAS-CoV-2 ont été utilisées pour contribuer à de nombreuses estimations MID, mais cet article se concentre autant que possible uniquement sur les études humaines.
"Bien que le MID du SRAS-CoV-2 chez l'homme a besoin de plus de recherche, il devrait être d'environ 100 particules virales. La seule étude humaine concernant un coronavirus a été rapportée pour le HCoV-229E et son MID est de 9 PFU. De plus, si la transmission par aérosol est le mode dominant, alors le MID serait plus faible.
"En fait, infections à base d'aérosols nécessitent moins de doses, par exemple, ~ 100 fois moins que les infections à base de gouttelettes.
"La dose minimale infectieuse du SRAS-CoV-2 causant la COVID-19 chez l'homme dans les études transversales et de séries de cas évaluées était faible ; dans une étude de série de cas qui a étudié la dose infectieuse dans 273 échantillons de 15 patients positifs pour le SRAS-CoV-2, la dose infectieuse minimale détectée était de 1.26 PFU in vitro dans le test COVID-19-RdRp/Hel.1 Dans une autre étude, 248 des échantillons oro-nasopharyngés d'individus COVID-19 ont été évalués et la dose infectieuse a été signalée comme étant de 364 PFU.
"Dans une étude de cas qui a évalué 97 enfants de 10 ans et moins, 78 enfants âgés de 11 à 17 ans et 130 adultes, la dose infectieuse chez les enfants de 11 à 17 ans était inférieure à celle de deux autres groupes (125 PFU). Les enfants avaient une croissance virale vivante plus faible, des seuils de cycle plus élevés et une concentration virale plus faible par rapport aux adultes, de sorte que les enfants ne sont pas les principaux porteurs d'infection. Les enfants âgés de ⩽10 ans étaient plus susceptibles d'être asymptomatiques que les autres.
"L'un des plus l'étude de Basu et al., dont l'objectif principal était d'évaluer la taille des gouttelettes qui ont une forte probabilité de provoquer une infection, en est une bien discutée (sic). Mais outre ce constat, ils avaient aussi quelques points liés à la charge virale qui peut provoquer l'infection. Ils ont constaté que le nombre de virions placés dans le nasopharynx d'un individu étroitement situé sur une durée de 2.5 h se rapproche de (11/5) virions par minute × 60 min × 2.5 h = 330. »
Des études comparatives incluant d'autres coronavirus ont montré que les PFU peuvent être assez faibles pour les virus respiratoires.
"Infectivité estimée de Le SRAS-CoV-1 était comparable à d'autres coronavirus, dont le HCoV-229E, un agent causal d'un rhume léger chez l'homme. ID10 et ID50 du SARS-CoV-1 ont été rapportés comme 43 et 280 PFU (400 TCID50) dans une étude expérimentale.
"L'identification humaine50 pour le sous-type de coronavirus saisonnier 229E qui provoque un rhume bénin chez l'homme a été signalé comme étant de 13 TCID50. »
Les chiffres discutés dans les études fournies sur le SRAS-CoV-2 étaient de 1.26, 100, 125, 330 et 363 PFU pour la transmission, parlant à nouveau d'un large spectre de susceptibilité.
Production de virions viables par rapport au potentiel de seuil de dose minimale infectieuse
En utilisant ces chiffres disponibles, nous pouvons aborder l'affirmation selon laquelle les N95 offrent une valeur protectrice significative contre les aérosols infectieux en examinant les contributions de sortie, le potentiel d'infectiosité de la matière virale émise, les plages de PFU, puis nous pouvons peser ces plages par rapport à une hypothétique capacité de capture parfaite des N95. capturant 95 % de la matière, contre les 5 % restants non capturés. Encore une fois, notez que les N95 ne sont pas conçus ni approuvés pour capturer <0.3 µm, et nous discutons d'un agent pathogène qui a une taille de particule viable minimale de 0.06 à 0.14 µm.
Émissions respiratoires d'un individu transmissible se sont avérés atteindre plus de 100,000 750,000 virions en une minute, bien que tous les virions émis ne puissent pas être supposés infectieux. D'autres articles de recherche ont revendiqué une production aussi élevée que XNUMX XNUMX virions/minute (mais les données à l'appui de telles affirmations font défaut). Il convient également de noter que nous n'inhalons bien sûr pas toutes les matières expirées d'un individu, mais notre proximité avec un individu transmissible, son taux d'émission, sa durée dans l'espace et la ventilation dans cet espace donné sont autant de facteurs qui auront un impact sur la probabilité de transmission qui ne peut être exprimé de manière linéaire ou prévisible.
Dans l'étude nous avons exploré ci-dessus, la plage positive à la PCR la plus élevée était de 34,772 64 particules par litre, celles émettant les plages de sortie les plus élevées représentant XNUMX% de la matière totale émise.
Dans un premier temps, nous allons créer une sortie horaire de chacune de ces plages, puis appliquez le rapport particules sur PFU pour chaque plage de 1,000 1,000,000 à XNUMX XNUMX XNUMX.
Plage de sortie A
Une heure d'un individu transmissible dans un espace clos émettant 100,000 6 virions par minute serait une sortie de 100,000 millions de virions (60 8 × 48 minutes). Une période de 100,000 heures dans un espace clos équivaut à 480 millions de virions émis (1,000 1,000,000 × 6,000 minutes). Avec le rapport particule sur PFU de 48,000 8 à XNUMX XNUMX XNUMX, cela nous donne XNUMX XNUMX virions viables en une heure, XNUMX XNUMX en XNUMX heures.
Les chiffres de PFU des études discutées donnés étaient de 1.26, 100, 125, 330 et 363 PFU requis comme dose infectieuse minimale. J'ai divisé chaque quantité de virions viables par chaque chiffre PFU pour obtenir chaque potentiel de seuil MID répertorié.
Plage de sortie B
Dans l'étude de collecte de particules PCR-positives, 34,772 64 particules par litre étaient la plage la plus élevée collectée, avec environ 10 % du total des particules émises et comptées provenant de 2 sources qui étaient parmi les plus touchées par leur infection par le SRAS-CoV-34,772 . Si l'on regarde 29 1,008,388 particules multipliées par un volume d'émission de XNUMX litres par minute, la plage de sortie est aussi élevée que XNUMX XNUMX XNUMX particules émises par minute.
Le manuel d'exposition de l'EPA répertorie une plage par minute aussi élevée que 53 litres par minute, donc l'utilisation d'un chiffre de 29 litres par minute n'est pas la plage de sortie la plus élevée possible. Les plages de débit de 7 et 29 litres par minute seront utilisées parce qu'il s'agit de plages de débit se situant dans des plages de niveau d'activité sédentaire à modérée.
À 29 litres par minute, multipliés par 34,772 1,008,388 particules par litre (60 60,503,280 1,008,388 particules), pour une durée de sortie de 60 minutes, le produit est de 484,026,240 8 1,008,388 (480 XNUMX XNUMX × XNUMX) particules par heure et de XNUMX XNUMX XNUMX par période de XNUMX heures (XNUMX XNUMX XNUMX × XNUMX minutes).
Avec un rapport particule sur PFU de 1,000 1,000,000 à 60,503 484,026 8 pour le COVID, cela nous donne XNUMX XNUMX virions viables émis par heure et XNUMX XNUMX virions viables par période de XNUMX heures.
Ces calculs nous donnent le potentiel de sortie d'un individu transmissible en termes non seulement du nombre de particules virales émises, mais aussi du potentiel d'atteinte du seuil MID pour infecter un nombre donné de personnes en fonction du chiffre PFU utilisé.
Bien que la gamme de PFU démontrée pour le SRAS-CoV-2 soit assez large, nous devons anticiper un spectre de transmissibilité basé sur l'état de santé individuel et la réponse immunitaire. Alors que 1.26 PFU semble assez faible, il a été démontré que le PFU pour le SRAS-Cov-1 est aussi bas que 13 PFU pour atteindre le seuil MID d'apparition de l'infection.
Même si une production d'émissions inférieure de 7 litres par minute est utilisée, cela donne un taux de 243,404 34,772 particules par minute (7 14,694,240 x 234,404)), 60 116,833,920 243,404 particules par heure (480 8 x 1,000) et 1,000,000 1 14,604 (116,833 8 x XNUMX) particules par XNUMX - période horaire. Avec un rapport particule sur PFU de XNUMX XNUMX à XNUMX XNUMX XNUMX appliqué, une période d'une heure correspond à une production de XNUMX XNUMX virions viables et de XNUMX XNUMX sur une période de XNUMX heures.

Avec ces plages de sortie d'intensité sédentaire à modérée, plusieurs fois le seuil MID est atteint pour tous les chiffres PFU établis.
Pourquoi les N95 ont échoué/échouent/échoueront
Les respirateurs avec un indice N95 sont conçus et approuvés pour capturer 95 % des matières non à base d'huile supérieures à 0.3 µm. Le SRAS-CoV-2 a une taille de particule viable minimale de 0.06 à 0.14 µm, bien en dessous du seuil de 0.3 µm même s'il est lié à une matière plus grande, il s'agit donc d'une hypothèse de capacité de capture parfaite pour une gamme de particules que ces appareils ne sont pas conçus ou approuvé pour la capture, et leurs données d'application n'ont pas montré qu'ils fonctionnent à ou près de 95 %.
Pour les besoins d'un exercice d'hypothétique capacité de capture parfaite, nous leur accorderons une hypothèse de taux de capture parfaite de 95 %. Si nous appliquons 5 % des chiffres MID démontrés à démontrés dans les plages de sortie A et B, cela démontrera l'infectivité des virions viables par rapport aux 5 % jamais capturés (par exemple, aucune fuite) si un taux hypothétique de 95 % parfait de la capture est satisfaite.
Plage de sortie A
Plage de sortie B
29 litres par minute
7 litres par minute
Si nous supposons une capacité de capture parfaite hypothétique pour les N95 de plages de taille de particules de matière que ces appareils ne sont pas conçus ou approuvés pour capturer, et appliquons les 5 % restants jamais capturés, la grande majorité des plages de sortie par rapport aux PFU requises pour répondre à la MID permettent toujours une exposition plusieurs fois supérieure au seuil MID pour une infection potentielle de nombreux individus sur des périodes de 1 heure et de 8 heures pour chaque plage de sortie établie.
Résumé
Nous sommes devenus laxistes avec nos normes d'atténuation lors de l'épidémie de SRAS-CoV-2, car cet agent pathogène n'est pas mortel pour l'écrasante majorité des gens, avec un taux de survie d'environ 99.8 %. Cette désinvolture envers une réponse spécifique au danger est incroyablement dangereuse lorsqu'elle est appliquée à des agents pathogènes et des éléments d'exposition plus mortels.
En examinant le meilleur scénario hypothétique, nous pouvons mieux prédire si une mesure donnée aura un impact d'atténuation sur le danger identifié. Pour les N95 par rapport à la sortie, les rapports particules sur PFU et le MID pour le SRAS-CoV-2, le meilleur scénario de capture parfaite hypothétique de la matière que ces appareils ne sont ni conçus ni approuvés pour capturer montre qu'ils ne sont toujours pas atténuants pour ce danger, et les recommandations pour leur utilisation doivent être immédiatement reconsidérées.
Ressources supplémentaires:
Discute de la charge virale moyenne à partir d'échantillons : https://www.nature.com/articles/s41586-020-2196-x.
Dose infectieuse minimale
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7090536/ (sur MID en général, pas spécifique au SARS-CoV-2).
Glossaire
aérosol – particules dispersées dans l'air ou le gaz, définies comme ayant une taille inférieure à 5 microns.
asymptomatique (propagation) – le concept théorique de transmission d'un agent pathogène à d'autres sans présenter de symptômes établis dudit agent pathogène.
saturation atmosphérique – la quantité de matière viable qui reste en l'air dans un espace clos.
émissions – matière respiratoire expirée.
régime de flux laminaire – particules fluides suivant des trajectoires lisses en couches.
dose minimale infectieuse – la quantité minimale de danger à laquelle une personne doit être exposée pour que l'apparition d'une maladie soit anticipée.
N95 - un respirateur filtrant les particules non capturant l'huile capable de bloquer jusqu'à 95 % des matières de plus de 0.3 µm.
début – le début d'une maladie s'installant une fois le seuil minimal de dose infectieuse atteint.
production - les émissions rejetées dans un environnement donné par un individu transmissible.
sortie comme une constante - un individu dans un espace clos émettant des aérosols respiratoires chargés de particules infectieuses dans l'atmosphère donnée, saturant davantage l'atmosphère donnée avec des matières infectieuses à chaque respiration.
rapport particule sur PFU – un rapport pour les calculs de sortie pathogène qui pèse le nombre total de particules émises par rapport aux particules qui sont viablement infectieuses.
PCR-négatif – un sujet de test donné ne reçoit pas de résultat de test positif lorsqu'il est testé avec la méthodologie PCR pour un agent pathogène donné. PCR signifie utiliser la technique de réaction en chaîne par polymérase.
PCR-positif – un sujet de test donné reçoit un test positif lorsqu'il est testé en utilisant la technique de réaction en chaîne par polymérase pour un agent pathogène donné.
capacité de capture parfaite – capture de matières dangereuses à un pourcentage d'efficacité correspondant donné par un produit comme son meilleur taux hypothétique possible.
Unités de formation de plaque (PFU) – la création de PFU nécessite qu'un virion infecte une cellule hôte, où commence la réplication virale. Un seuil d'un nombre donné de PFU est requis pour l'apparition de la maladie, connu sous le nom de dose infectieuse minimale.
Copies d'ARN - matériel génétique nécessaire pour faire des copies de protéines dans une cellule. Les copies d'ARN ne correspondent pas à des virions viables capables de se répliquer.
TCID50 – abréviation de dose infectieuse de culture tissulaire, qui est la dilution d'un virus nécessaire pour infecter 50 % des cellules dans un test de culture.
charge virale – la quantité de particules virales dans une substance donnée, une émission ou dans le corps d'un individu transmissible.
viabilité virale – des virions capables d'infecter une cellule et de créer des unités formant plaque (PFU).
virion ou virion viable- une particule virale infectieuse complète.
Publié sous un Licence internationale Creative Commons Attribution 4.0
Pour les réimpressions, veuillez rétablir le lien canonique vers l'original Institut Brownstone Article et auteur.









