The Telegraph a récemment rapporté que le public avait été invité à cesser de prendre des médicaments contre la toux et le rhume en raison de craintes pour la sécurité concernant le médicament, la pholcodine, un antitussif opioïde.
Vingt des médicaments courants contre la toux et le rhume, y compris les gélules Day and Night Nurse, ont été retirés d'urgence du marché sur ordre des autorités de réglementation des médicaments en raison de préoccupations concernant un risque "très rare" d'anaphylaxie, un effet indésirable potentiellement mortel.
L'annonce du "rappel de médicaments de classe 2" tirée de la décision du gouvernement britannique site , est illustré ci-dessous.

En ce qui concerne les vaccins à ARNm COVID-19, les doubles standards réglementaires n'ont jamais été aussi flagrants.
L'anaphylaxie a été identifiée comme un risque important par l'Agence européenne des médicaments, dès décembre 2020, dans le CHMP (Comité des médicaments à usage humain) de l'EMA rapport d'évaluation sur le vaccin Pfizer-BioNTech COVID-19, voir ci-dessous.
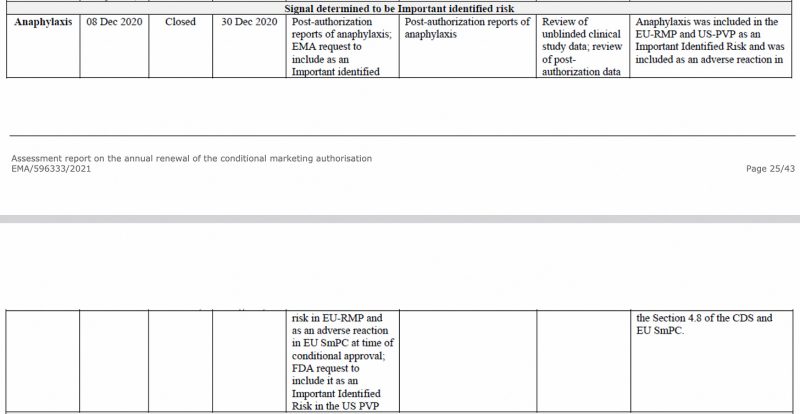
En outre, dans la première mise à jour périodique de sécurité de l'UE Rapport, que j'ai déjà analysé, l'anaphylaxie a de nouveau été signalée comme un risque identifié important.

Dans ce rapport de pharmacovigilance, 3,827 XNUMX cas pertinents (individus) ont été identifiés, à partir des données post-autorisation. Le pays avec l'incidence la plus élevée était le Japon, suivi des États-Unis et du Royaume-Uni.
Le plus grand nombre de cas signalés concernait les femmes, un nombre choquant de 3,182 454 cas contre 44 cas pour les hommes, avec un âge médian de 7 ans. Le fait que 2021 fois plus de cas aient été signalés chez les femmes n'est pas nouveau. En décembre XNUMX, j'ai analysé le Pfizer a préparé document pour la FDA, couvrant la période de 3 mois, de décembre 2020 au 28 février 2021 - dans le cas de l'anaphylaxie - les femmes étaient 8 fois plus touchées.
Ainsi, 98 % des événements indésirables pertinents (y compris réaction anaphylactique, choc anaphylactique, réaction anaphylactoïde et choc anaphylactoïde) ont été classés comme graves !
De plus, pour 92 % des événements, le temps écoulé avant qu'un événement indésirable ne se produise après l'administration du vaccin était inférieur à 24 heures.

Issues fatales
Sur les 3,922 28 événements, 704 ont été mortels et pour un nombre stupéfiant de XNUMX, l'issue était inconnue. Aucun numéro de cas n'a été donné pour les issues fatales.

Cas par groupe d'âge
Sur les 3,827 23 cas pertinents (individus), 3,021 appartenaient au groupe d'âge pédiatrique et XNUMX XNUMX au groupe d'âge adulte.
Présence de comorbidités
Ce qui est remarquable, c'est qu'environ 2/3 de tous les cas d'anaphylaxie ont ne sauraient avez des comorbidités (problèmes de santé sous-jacents).

Compte tenu de ce qui s'est passé depuis le déploiement des vaccins à ARNm COVID-19, il n'est pas surprenant de lire: "aucune nouvelle information sur la sécurité n'a été identifiée concernant le risque d'anaphylaxie avec le BNT162b2 » (vaccin Pfizer-BioNTech COVID-19). La raison invoquée (ou l'excuse derrière laquelle ils se cachent) est que « ce risque est communiqué », ce qui inclut des informations sur les mesures appropriées à prendre, comme suit : « Comme pour tous les vaccins injectables, un traitement médical et une surveillance appropriés doivent toujours être facilement disponibles. en cas d'événement anaphylactique rare suite à l'administration du vaccin.
Sous Règle 174, Informations pour les professionnels de la santé au Royaume-Uni, qui a été révisé pour la dernière fois en décembre 2021, ce qui suit est indiqué :

n fait, sur le très premier jour du déploiement du vaccin Pfizer-BioNTech COVID-19 au Royaume-Uni, il y a eu deux rapports d'anaphylaxie et un cas signalé de réaction allergique possible. Cela n'a pas empêché la MHRA de rappeler le produit - ils ont simplement évité le problème en déclarant que les personnes ayant des antécédents d'allergies ne devraient pas prendre le vaccin.
Même lorsqu'ils savaient, les ingrédients de nanoparticules lipidiques ALC-0159 et ALC-0315 de Pfizer/BioNTech n'ont jamais été inclus dans un médicament homologué auparavant. ALC-0159 contient du PEG (polyéthylène glycol) qui est connu pour provoquer l'anaphylaxie.
C'est sans équivoque : l'anaphylaxie était un événement indésirable potentiellement mortel connu, à peu près au même moment où l'autorisation d'utilisation d'urgence a été accordée pour le vaccin Pfizer-BioNTech COVID-19. Pourtant, parce qu'il s'agit d'un "vaccin injectable", il a en quelque sorte obtenu un laissez-passer gratuit de tous les régulateurs de médicaments, quelle que soit la quantité de données accablantes accumulées, lorsqu'un sirop ou une capsule contre la toux est rappelé d'urgence sur la base d'un "un risque très rare d'anaphylaxie.
Réédité de l'auteur Sous-empilement
Publié sous un Licence internationale Creative Commons Attribution 4.0
Pour les réimpressions, veuillez rétablir le lien canonique vers l'original Institut Brownstone Article et auteur.









