
Au cours des dernières décennies de ma carrière, j’ai passé d’innombrables heures à travailler pour protéger les Américains en effectuant des recherches sur la sécurité des médicaments. Mon éducation et ma carrière m'ont conduit dans environ une demi-douzaine d'universités, dans les grandes sociétés pharmaceutiques et à la FDA sous trois administrations présidentielles. La sécurité des médicaments prend en compte la raison pour laquelle une personne peut prendre un produit pharmaceutique et ne subir aucun effet indésirable, alors qu'une autre personne pourrait prendre le même produit mais subir des effets indésirables pouvant aller jusqu'à une invalidité permanente ou la mort. Par défaut, l’étude de la sécurité des médicaments prend également en compte les aspects non cliniques de la fabrication et de la qualité des médicaments.
Parce que la qualité des médicaments est un facteur essentiel dans l’évaluation de leur sécurité, mes efforts pour protéger les Américains m’ont conduit à conceptualiser et à fonder la première «pharmacie analytique» avait pour mission de vérifier scientifiquement les produits pharmaceutiques provenant de pays comme l’Inde et la Chine avant de les distribuer aux patients. Malheureusement, la recherche de largesses en matière d’éthique et de protection des patients a conduit la direction financière de cette entreprise à s’engager les Violations de la FDA et être accusé par les juges d'avoir fait fausses affirmations scientifiques (ce qui s'est produit par hasard après ma sortie).
Sans confirmation extérieure de la qualité des médicaments, les Américains dépendent entièrement de la FDA et des fabricants pour évaluer et confirmer la pureté des produits. Il a été démontré que la sécurité des médicaments constitue un problème notable en ce qui concerne les injections d’ARNm du Covid. Malheureusement, si quelqu’un voulait mener sa propre analyse des injections d’ARNm, il ne disposent pas d'une liste d'ingrédients suffisamment détaillée à laquelle le comparer, ni même d'un accès à la méthodologie réglementaire établie sur la façon de tester correctement sa pureté.
C'est parce que les fabricants ainsi que la FDA prend en compte tous les ingrédients de ces injections d'ARNm, y compris la séquence d'ARNm et les propriétés des nanoparticules lipidiques (LNP), y compris la demi-vie, les structures des LNP, les modifications de surface, le nombre/le(s) type(s) de LNP par dose et les points d'attache sur le brin d’ARNm, non spécifié ou « secret commercial ».
En plus de cela, la FDA considère également le méthodologies sur la façon de tester la pureté des injections d’ARNm est également un secret commercial.
Un soutien bipartisan et des centaines de milliards de dollars des contribuables, mais AUCUNE transparence ?
Le secret de l’ARNm du Covid existe même si les administrations Trump et Biden avaient proposé une transparence totale avec les injections d’ARNm au point de lever les droits de propriété intellectuelle de l’ARNm du Covid. Malgré cela, la FDA et les fabricants autorisent/gardent un contrôle strict sur les brevets, y compris les données de base sur ces injections, en tant que secret commercial. Ils le font bien que tous les fabricants de vaccins Covid aient reçu des centaines de millions de dollars des contribuables selon Forbes/Statistique publications.
Étudier l’épidémiologie de la sécurité des médicaments est déjà assez difficile. Sans pureté/cohérence vérifiable du produit, une évaluation complète de la sécurité est impossible.
La transparence totale de tous les ingrédients et les mesures de contrôle de qualité sont importantes non seulement parce qu’elles ont été largement financées par les contribuables à hauteur de centaines de millions de dollars, mais aussi parce qu’une multitude de questions ont été soulevées quant à la sécurité et à l’efficacité des injections d’ARNm du Covid.
En plus d'être exceptionnellement complexe, leur approbation a été accélérée par les régulateurs après moins d'un an. La plupart des médicaments et des vaccins prennent généralement dix ans pour tester entièrement la sécurité/efficacité, puis examiner et approuver. En plus du fait que les ingrédients sont complètement nouveaux, très complexes et les premiers du genre à être administrés à grande échelle, le développement comprenant les évaluations cliniques de sécurité/toxicité à long terme et les examens épidémiologiques ont été accélérés et probablement pas entièrement élucidés avant la publication.
La vérification des ingrédients, la transparence et la « véracité » de la FDA ont des précédents remontant aux années 1800 :
La vérification analytique et la transparence des ingrédients ou « vérité dans l'étiquetage » là où se trouve le contenu de la bouteille conditions pour correspondre aux ingrédients indiqués est antérieur à la création de la FDA, remontant à 1862. La FDA actuelle est en fait née de ce qui a commencé comme un seul employé du « Département de Chimie » employé au Département de l’Agriculture des États-Unis.
Falsification, (ingrédients altérés ou toxiques) erreur de marque (contient une fausse étiquette ou est autrement trompeur, ou contient des allégations médicales incorrectes), ou étiquetage erroné (contient des ingrédients qui ne sont pas répertoriés sur l'étiquette du produit) ont tous eu une longue et laide histoire en Amérique. On pensait que le caractère flagrant avait atteint son apogée entre le début et le milieu du XIXe siècle – ou du moins c’est à ce moment-là qu’il est devenu identifiable – car ce n’est qu’en 19 que des processus techniques ont été développés pour analyser et détecter la fraude aux ingrédients. Avant cela, les soi-disant « guérisseurs ambulants » se faisant appeler « médecins » (invariablement avec des références douteuses ou inexistantes) colportaient des bouteilles de produits « panamériques », dont les étiquettes d'ingrédients ne listaient que des contenus nébuleux ou inoffensifs tels que "vitamines""extraits de plantes,oul'huile de serpent" – ou n'ont souvent aucune liste d'ingrédients du tout.
À l'époque, de nombreux habitants fervents et puritains de la Nouvelle-Angleterre, qui, pour des raisons religieuses, voulaient n'allons jamais toucher de l'alcool, achèterait ces solutions à ces colporteurs et se laisserait, sans le savoir, consommer des solutions contenant non seulement de l'alcool, mais aussi des stupéfiants tels que l'opium et/ou la cocaïne. Sous prétexte d’améliorer une corne d’abondance absurde de maladies, les patients ont plutôt développé une dépendance punitive et/ou ont vu leur santé affectée négativement par ces premiers « trafiquants de drogue ».
À mesure que le problème s’aggravait, le gouvernement fédéral a commencé à en prendre note. Finalement, le Loi sur les aliments et drogues pures a été adoptée en 1906 et a conduit à la création de la Food and Drug Administration (FDA).
[La FDA avait un formatif devoir de garantir que les médicaments portent des déclarations d'étiquetage véridiques et répondent à certaines normes de pureté et de concentration.
Rappelez-vous que près de 120 ans exigence d'étiquetage véridique et la partie « pureté » de la Pure Food and Drug Act de 1906 pendant que vous continuez à lire sur les tests de vérification de l'ARNm et la transparence des ingrédients.]
Quels tests de vérification des ingrédients « véridiques » et « purs » sont effectués pour les produits réglementés par la FDA ?
En 2021, la FDA a choisi de commencer à surveiller la qualité pharmaceutique américaine via un collecte à distance of soumission des échantillons par la poste pour les médicaments en remplacement des inspections en direct des installations en raison de la pandémie de Covid. Etait-ce légal ? Cela pourrait-il un jour être considéré comme scientifiquement approprié ? Aujourd'hui, malgré la fin de la pandémie, les seuls tests officiels de libération pharmaceutique actuellement effectués sur tous Produits pharmaceutiques à ARNm du Covid apparaît à toujours être effectué par la FDA via un fournisseur fourni par le fabricant, "envoyé par la poste » échantillon selon un capture d'écran du site Web actuel de la FDA. De toute évidence, une méthode d’échantillonnage « par la poste » est très différente et potentiellement moins fiable que la collecte directe d’échantillons via une méthode de collecte directe en personne. Malgré cela, la FDA affirme avoir «la norme la plus élevée au monde en matière d’échantillonnage et de test. »
En outre, la FDA propose de faire progresser davantage sa politique de tests à distance « par courrier » avec un document d'orientation nouvellement proposé.
Bien qu’il n’existe qu’en tant que « projet » de document de la FDA, les sites Web officiels de la FDA montrent que l'envoi d'échantillons par la poste semble déjà mis en œuvre depuis au moins janvier 2021. La FDA semble affirmer que les résultats de ces tests envoyés par courrier constituent une vérification indépendante.
De plus, le bas de la première page du projet de la FDA Le document propose l’expansion des « tests à distance ». Il répertorie actuellement chaque Division de réglementation des produits de la FDA, ce qui implique qu'il s'agit d'une proposition politique à l'échelle de l'agence.
La liste complète comprend les :
- Bureau des affaires réglementaires
- Bureau de la politique et de la réponse alimentaires
- Bureau des produits combinés
- Centre d'évaluation et de recherche sur les produits biologiques
- Centre d'évaluation et de recherche sur les médicaments
- Centre des appareils et de la santé radiologique
- Centre de sécurité sanitaire des aliments et de nutrition appliquée
- Centre des produits du tabac
- Centre de médecine vétérinaire
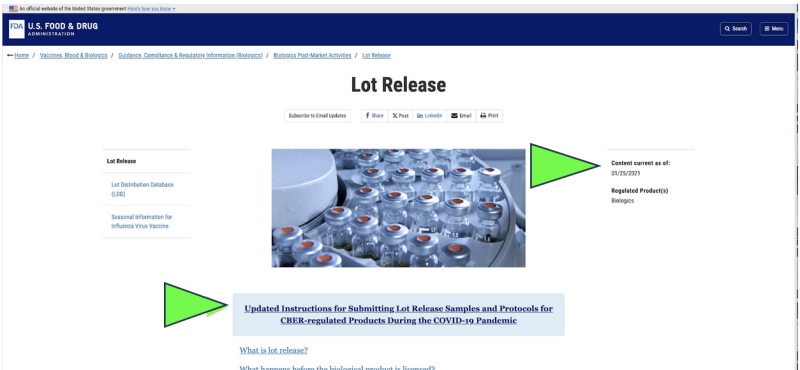
L’échantillonnage de contrôle qualité « envoyé par la poste » par la FDA est-il approprié ? Et si les inspections des restaurants du ministère de la Santé des États reflétaient la politique de la FDA ?
Cette méthodologie d'échantillonnage « par courrier » est tout aussi absurde que, par exemple, le service de santé d'un État surveillant les restaurants en leur demandant d'« envoyer » périodiquement divers éléments de leur menu à un centre de test afin que les services de santé puissent tester la présence d'aliments potentiels. contamination née et/ou demander aux restaurants de promettre de tester eux-mêmes les éléments du menu. Et si ce restaurant était en Chine ? Et si ce restaurant était en Inde ? Ou tout autre pays connu pour avoir un un historique épouvantable de fraude et de contrôle qualité problèmes?
Cette méthodologie serait inacceptable tant pour les restaurants que pour les sociétés pharmaceutiques, pour des raisons évidentes : les fabricants pourraient envoyer les échantillons qu’ils préfèrent – pas nécessairement des échantillons de lots représentatifs. Ce n’est évidemment pas la même chose que les inspecteurs de la FDA qui acquièrent des échantillons lors d’inspections inopinées de l’ensemble de l’installation.
Sous l’analogie du restaurant, bien sûr, tous les restaurants soumettre des échantillons de qualité « A » ce qui ne serait pas nécessairement représentatif de ce que reçoivent les consommateurs.

Contrôle qualité : qu’est-ce que le « test de libération » pharmaceutique et pourquoi est-il important ?
Aujourd'hui, la FDA supervise la qualité et le contenu des $2.7 billion valeur du produit par an, mais semble supprimer les évaluations et les résultats de la vérification des ingrédients critiques. La FDA est censée protéger les Américains en menant des complet tests analytiques comme somme de contrôle pour garantir l’exactitude des ingrédients. Les résultats devraient être transparents pour les contribuables qui financent le Les 6.6 milliards de dollars de la FDA budget. Cette vérification scientifique est qualifiée de pharmaceutique »test de version.» Les tests de version sont un terme technique désignant un processus impliquant une variété d'analyses instrumentales utilisées pour globalement tester les produits pour la pureté, la concentration, la cohérence, l’identité et les impuretés de toute nature.
La FDA dans son ensemble est née de cet employé du « Département de chimie » de 1862 et du besoin de transparence et de vérification des ingrédients. Aujourd'hui, cet employé est devenu un l'ensemble du département FDA composé de 1,300 XNUMX scientifiques et personnel de soutien soi-disant dédié à la vérification des ingrédients via des tests de libération pharmaceutique. La FDA Bureau de la Qualité Pharmaceutique (OPQ) est censé garantir que les produits pharmaceutiques correspondent exactement au contenu des ingrédients répertoriés, sans variabilité de la qualité/impureté (qualitative) ou du contenu (qualitatif). Les règles exigeant cela sont très spécifiques et détaillées dans 21 CFR § 201.10.
Comment la FDA vérifie les injections d’ARNm pour le contrôle qualité :
Les résultats du contrôle qualité des tests d’injections d’ARNm étaient particulièrement critiques car ils sont volumineux, complexes et ont été réalisés rapidement. Alors que les contribuables dépendent de la FDA pour vérifier la qualité des injections d’ARNm et partager les résultats, la FDA semble obligé de protéger les ingrédients des fabricants au détriment de la transparence la plus élémentaire concernant les produits à ARNm Covid. Même si la FDA semble collecter des échantillons, sa méthodologie « d’envoi par la poste » est fondamentalement erronée. De plus, la FDA ne partage les résultats de ces tests nulle part où je pourrais les localiser.
En d’autres termes : pendant la pandémie, lorsque de toutes nouvelles injections d’ARNm largement mises en œuvre étaient imposées aux Américains à une « vitesse fulgurante » et lorsque l’Amérique comptait le plus sur les devoirs de qualité et de réglementation de la FDA, la FDA acceptait les « courriers » auto-soumis. dans » les tests de contrôle qualité et/ou les résultats. La FDA n'a-t-elle pas considéré que Les fabricants d’ARNm ont admis qu’ils « avaient du mal » à répondre à la fabrication et qu’ils « se démenaient » pour suivre le rythme. avec les processus de fabrication ? Les fabricants d’ingrédients à base d’ARNm ont en outre déclaré que les efforts visant à répondre aux besoins étaient « sans précédent ».
Des déclarations comme celle-ci ne renforcent pas la confiance des consommateurs dans la qualité et illustrent une formidable expansion de ces produits complexes qui devraient justifier particulièrement vigilant et un examen en personne par la FDA des installations et des produits manufacturés, pandémique ou non. Un fabricant d’ingrédients à base d’ARNm, par exemple, a déclaré avoir soudainement augmenté sa production en 50 fois.
Au milieu de cette nouvelle technologie mise en œuvre à toute vitesse, aucun des 1,300 XNUMX scientifiques de l’OPQ à la FDA n’a exigé des inspections en direct, ou du moins n’a proposé de faire autre chose que de demander des échantillons « envoyés par la poste » potentiellement douteux. pour tester?
La question évidente est: pourquoi la FDA n'a-t-elle pas collecté d'échantillons directement? Même avec la pandémie en place, la FDA aurait pu inspecter les installations portant des combinaisons de protection contre les matières dangereuses ou – ou au très au moins – ont choisi de collecter des échantillons dans les pharmacies, les hôpitaux ou dans les entrepôts des distributeurs.
Méthodologie cachée pour tester les ingrédients d’injection d’ARNm :
Au-delà de l’absence de résultats de tests et de résultats d’échantillonnage douteux « envoyés par la poste », la FDA est plus dissimuler leur méthodologie validée, empêchant d’autres d’effectuer leurs propres analyses indépendantes sur la qualité/pureté des injections d’ARNm.
Analyser indépendamment la pureté et la contamination potentielle des médicaments par rapport à la liste des ingrédients est quelque chose que j'avais tenté de faire moi-même lorsque j'ai conceptualisé le premier projet au monde. pharmacie analytique. Cependant, étant donné que les injections d’ARNm constituent une nouvelle technologie avec une liste d’ingrédients loin d’être totalement transparente, la méthodologie de test qu’il faudrait employer n’est pas simple comme elle le serait pour d’autres médicaments à petites molécules. Quiconque essaie de rechercher le stockage, la stabilité, la spécificité, la chimie, la sensibilité ou même la méthodologie de base pour tester la validation et/ou les résultats est bloqué par un rapport de la FDA contenant des expurgations ridiculement invasives, rendant même la compréhension scientifique la plus fondamentale de la façon d'évaluer potentiellement résultats ou effectuer des tests impossibles.
À titre d'exemple visuel poignant, une seule page rédigée dans un résumé réglementaire plus long de la FDA (illustré ci-dessous) fait partie d'un Document 127 (dont seulement 63 pages ont été partagées, et sur ces 63 pages, environ 50 % ont été expurgées) sur la façon d'évaluer la pureté, la concentration et d'autres mesures analytiques des injections d'ARNm.
Ceux Expurgations FDA (b)(4) des expurgations détaillées spécifiées utilisées pour «protéger les secrets commerciaux et les informations commerciales ou financières confidentielles.» Mais est-il vraiment approprié de le qualifier de « commercial » si la recherche/développement/produit a été financé par des centaines de millions de dollars des contribuables?

Sans une liste d'ingrédients ou une méthodologie de test, il est impossible pour quiconque en dehors de la FDA ou des fabricants de savoir précisément comment vérifier la présence d'un produit. falsification (ingrédients altérés ou toxiques) ou étiquetage erroné (car une liste complète des ingrédients, y compris la séquence nucléotidique et le configurations de nanoparticules lipidiques sont particulièrement vagues sur l'étiquette du produit).
Le manque de méthodologie est particulièrement gênant puisque de nouvelles données préliminaires utilisant une méthodologie indépendante ont montré des preuves de Contamination de l’ADN dans les injections d’ARNm Covid.
Ainsi, si une personne extérieure prétendait avoir testé et trouvé une impureté dans les injections d’ARNm et demandait sa réponse à la FDA ou aux fabricants, elle recevrait une réponse indiquant quelque chose du genre :
- Vous n'avez pas utilisé de méthodologie de test validée/appropriée pour tirer vos conclusions et vos analyses sont donc invalides.
Pour cela, le laboratoire indépendant tenterait de demander la méthodologie de test à partir de la documentation approuvée par la FDA (c'est-à-dire le document complet contenant Figure 5) en demandant : « D'accord, j'aimerais le tester en utilisant votre méthodologie approuvée ; Veux-tu nous dire ce que c'est ?
- La FDA ou le fabricant répondrait quelque chose du genre : «Ce que nous sommes prêts à divulguer sur la méthodologie employée et qui n'est pas confidentiel peut être trouvé en ligne ou via une demande FOIA de la FDA.« …là où ils seraient rencontrés le document suivant fortement expurgé, où tout ce qui a un sens est masqué par des expurgations (b)(4).
Lire entre les lignes : il est évident que les fabricants et la FDA américaine ne veulent pas que quiconque d’autre qu’eux-mêmes connaisse les ingrédients complets des injections d’ARNm ou même teste leur pureté et leur cohérence.
Selon les responsables de la FDA : La fabrication de produits pharmaceutiques est Très Sujet aux erreurs :
Merci beaucoup les choses peuvent mal se passer – et se produisent – au cours du processus de fabrication pharmaceutique. Au-delà des incohérences potentielles avec les injections d’ARNm/LNP, des problèmes qualitatifs et quantitatifs impliquent chaque Produit pharmaceutique réglementé par la FDA. Même la Chambre et le Sénat ont officiellement reconnu les informations faisant état de l’échec de la FDA à sécuriser la chaîne d’approvisionnement pharmaceutique américaine. La majorité des Le secteur pharmaceutique américain produit consommateur-utilisateur finalest en cours de production à l'étranger dans des pays comme l'Inde et la Chine, et d'autres pays à faible coût de main-d'œuvre sont ne sauraient bien considéré pour ses niveaux élevés de contrôle de qualité. Le Federal Register regorge de rapports sur violations dans les usines de fabrication indiennes et chinoises.
La FDA certifie-t-elle également ces usines – y compris celles ayant de longs antécédents de violations – via un système « d’envoi par la poste » à la FDA ? Outrageusement, la réponse à cette question mettrait très mal à l’aise quiconque s’intéresse à la qualité pharmaceutique.
Alors qu'une Six Sigma Le niveau de précision a longtemps été l'objectif en matière de qualité et de sécurité dans l'industrie automobile, informatique, téléphonique mobile et dans d'autres secteurs de fabrication de haute technologie, mais il semble avoir été largement négligé lorsqu'il s'agit de fabrication pharmaceutique.
Les responsables de la FDA ont publié des données estimant une imprécision de 2 à 3σ (sigma) dans la fabrication pharmaceutique. Une qualité 2σ correspond à 308,537 1,000,000 défauts pour XNUMX XNUMX XNUMX d'opportunités. (Il existe probablement bien plus d’un million de possibilités d’erreur en matière de fabrication pharmaceutique.) La FDA en est consciente aux plus hauts niveaux de direction ; en fait, le courant Michael Kopcha, chef du Bureau de la qualité pharmaceutique de la FDA a même écrit et publié le calcul Six Sigma ci-dessus, déplorant la nature imprécise de la fabrication pharmaceutique retour à 2017.
La latitude d’erreur pour les produits d’ARNm et/ou leurs LNP pourrait même être moins précis que le 2-3σ (plus le σ est bas, plus un produit est erroné) car ils contiennent du matériel nucléotidique et de nouveaux LNP, ce qui les rend considérablement plus complexes que les produits pharmaceutiques à petites molécules – bien qu’ils soient développés, fabriqués et commercialisés à « vitesse de l'éclair."
Même la FDA et ses responsables reconnaissent une imprécision inhérente à la fabrication, pourquoi dans le vaste monde du sport la FDA ne remplit-elle pas sa mission de sécurité en partageant publiquement ses tests de libération de la technologie ARNm avec le public américain qui les finance ?
Encore une fois avant 1862 ? Les injections d’ARNm sont-elles les seuls médicaments pour lesquels les Américains n’ont pas ! Informations sur les ingrédients ?
Le manque de clarté sur le nombre de séquences d’injections d’ARNm et d’autres informations critiques contraste directement avec un autre médicament à base d’ARN approuvé par la FDA – patisiran (Onpattro®). Onpattro fournit de manière transparente la séquence, le poids moléculaire et la force en milligrammes de ses produits selon les normes officielles de la FDA. étiquetage des colis comme illustré dans un extrait ci-dessous :


Manque de spécificité de dose d’ARNm Covid : 0.3 ml (ou 0.5 ml) de quoi?
Pour l’instant, nous ne disposons toujours pas d’informations de base sur les ingrédients d’une injection d’ARNm de Covid. Les pharmaciens savent seulement donner un le volume de fluide, et cela semble être fait sans poser de questions. Normalement, l’étiquetage officiel de l’emballage de la FDA devrait détailler les ingrédients réels de ce volume, mais pas pour les étiquettes d’ARNm de Covid : elles indiquent simplement 0.3 ml (ou 0.5 ml) comme « forme posologique et concentration ».
De plus, comme n’importe quel étudiant du secondaire pourrait vous le dire, 0.3/0.5 ml est un le volume, pas un force. Nous ne connaissons aucun détail quantitatif de ce qui est contenu dans ces 0.3/0.5 ml, tels que : combien de particules LNP ? Quelle taille/morphologies de ces LNP ? Combien de séquences d’ARNm dans ce volume ?




Est-ce ce qui est considéré comme un étiquetage suffisamment transparent ou « véridique » par la FDA ?
L’extrait ci-dessus, copié-collé de la notice d’emballage, contient toutes les informations que les fabricants partagent avec les consommateurs concernant la dose – qui est malheureusement inadéquate par rapport à toutes les autres étiquettes de la FDA – ou avec toute personne curieuse de savoir autre chose que la quantité de liquide. à injecter et la concentration de 30 ou 100 mcg d'une séquence d'ARNm non précisée.
L’imprécision remarquable de cette étiquette autorisée par la FDA semble entrer spécifiquement en conflit avec son étiquette vieille de près de 120 ans : «exiger que les aliments et les médicaments portent des déclarations d'étiquetage véridiques et répondent à certaines normes de pureté et de concentration. »
Est-ce ce qui est considéré comme une liste d’ingrédients « véridique » par la FDA ? (Voir 21CFR §352et 21 CFR §201.10 concernant la « déclaration des ingrédients » et les « médicaments et dispositifs mal étiquetés »).
La question est : est-ce qu'il existe une liste d'ingrédients inconnus ou non spécifiques que personne, à l'exception du fabricant, ne peut déchiffrer ? vraiment répondent-ils à l’esprit ou aux exigences légales de « l’étiquetage ? Cette étiquette est-elle considérée comme « véridique » par la FDA américaine ? De quel côté est la FDA de toute façon ? fabricants ou consommateurs ?
En plus de ne pas être directement précisé, le nombre exact de brins de LNP ou d’ARNm dans une injection de 30 ou 100 mcg ne peut même pas être extrapolé. stœchiométriquement ou sur la base de Le numéro d'Avogadro, car la séquence d’ARNm, le poids moléculaire et/ou les composants/configurations LNP ne sont fournis nulle part dans l’étiquetage officiel de la FDA.
Comment peut-on savoir si le nombre de brins d’ARNm pour coder la protéine de pointe pour Covid est proportionnel à la charge d’inoculum Covid que l’on recevrait d’une infection contractée dans la communauté ? Répondre: ils ne peuvent pas.
Les injections d’ARNm de Covid sont-elles Correctement étiqueté/mal étiqueté?
21 CFR 211.125 précise «Un contrôle strict doit être exercé sur l'étiquetage délivré pour être utilisé dans les opérations d'étiquetage des produits pharmaceutiques," mais il semble que la FDA ait été si laxiste avec son étiquetage approuvé des injections d'ARNm de Covid malgré le fait que tous les autres médicaments – y compris Onpattro à base d’ARNm – précisent ces informations. Historiquement, les décisions réglementaires de la FDA (telles que les informations à inclure dans l’étiquetage des produits) sont basées sur la préséance, et les injections d’ARNm de Covid constituaient un écart évident par rapport à la préséance historique et juridique de la FDA. Cette absence remarquable de données et ce manque de clarté nous rappellent en quelque sorte l’époque de Cordial de foie et de rein de Morley à la fin des années 1800. La différence est la suivante : à l’époque, la FDA n’existait pas, mais il existe aujourd’hui une FDA comptant environ 20,000 XNUMX employés, dont au moins certains croyaient ostensiblement que cette étiquette était transparente et « véridique ».
Déclarer un ingrédient inconnu/indéchiffrable/obscur que personne ne pourra jamais déterminer avec précision n'est probablement pas ce que les législateurs de la Pure Food and Drug Act de 1906 avaient prévu lorsqu'ils ont précisé les règles de la FDA sur « l'étiquetage véridique ». A part ça : le fait que les doses sont doublées par volume chez différents fabricants (30 mcg/0.3 ml vs 100 mcg/0.5 ml) signifie que ces séquences d'ARNm semblent être très différentes en termes de longueur de nucléotides et, à leur tour, auraient des LNP plus nombreux et différents ainsi que des pièces jointes. Cela signifie-t-il que les séquences d'ARNm utilisées pour transcrire la protéine de pointe sont environ le double de la taille (10 mcg/0.1 ml contre 20 mcg/0.1 ml) par rapport aux différents fabricants, ou est-ce que quelque chose d'autre contribue à la différence de longueur des nucléotides ?
Pour le profane qui lit encore jusqu'à présent (félicitations, d'ailleurs) : le manque d'informations détaillées sur l'étiquetage pourrait être comme une large publicité pour une maison à vendre, affirmant qu'elle est faite de bois et de briques, sur une dalle de ciment – mais sans montrer. toutes les photos de la maison (par exemple, séquence) et ne partageant pas sa superficie (par exemple, poids moléculaire). Dans tous les cas, le manque d’informations est insuffisant et constitue un écart par rapport aux normes traditionnelles.
Tous les autres médicaments approuvés par la FDA – y compris les autres médicaments à ARNm – contiennent des informations complètes sur les ingrédients de leurs produits, y compris une représentation structurelle et un poids moléculaire de leur produit afin que les gens sachent exactement ce qu'ils obtiennent.
C’est vrai : recherchez n’importe quel médicament auquel vous pouvez penser dans le Base de données Drugs.com et remarquez comment toutes les étiquettes fournissent la structure et/ou le poids moléculaire. Preuve que les injections d’ARNm du Covid sont un visible exception à la pratique historique d’approbation de la FDA et à la règle de « l’étiquette véridique ».
Une étude danoise de 2023 détaille la variabilité clinique significative entre les lots d’injections d’ARNm Covid-19 :
L’absence de transparence sur la validation des tests, même potentiellement invalides, « envoyés par la poste », semble avoir donné aux fabricants une marge de manœuvre sur une autre partie d’une importance cruciale de ce que la FDA supervise : les manifestations cliniques potentielles sur les variations de lots d’injections d’ARNm. Une rétrospective Étude danoise sur la sécurité publié plus tôt en 2023 a détaillé un modèle très déviant de rapports d'événements indésirables provenant des injections d'ARNm Pfizer-BioNTech BNT162b2, corrélé avec le système danois de notification des événements indésirables DKMA.
Dans le graphique linéaire qui suit, des points de couleurs différentes représentent différents lots d’injections d’ARNm de Pfizer-BioNTech. Il a séparé les lots en trois catégories différentes ; nombre élevé, faible à (presque) absent de groupes d'événements indésirables signalés (tracés bleus, verts et jaunes respectivement).
En d'autres termes: Les produits prétendument « équivalents » du même fabricant semblent avoir des incidences d’événements indésirables très différentes, par lot, chacun de ces lots représentant des centaines de milliers d’injections d’ARNm.
Lorsque les droites de régression linéaire correspondantes ont été ajoutées, un modèle particulier est apparu :
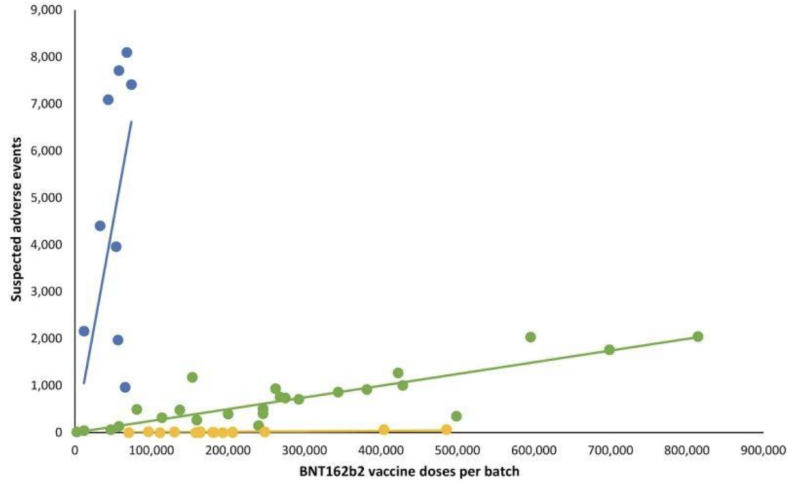
Les questions importantes concernant la disparité notable des événements indésirables entre les lots d’ARNm de Covid-19 comprennent :
- Les variations des événements indésirables pourraient-elles être dues à des variations qualitatives ou quantitatives dans les séquences d’ARNm ou dans le nombre de brins d’ARNm entre les lots ?
- Les écarts liés aux événements indésirables pourraient-ils être dus à des écarts qualitatifs ou quantitatifs dans la taille/morphologies ou la quantité de LNP entre les lots ? Quels tests ont été effectués pour assurer la sécurité des différentes LNP utilisé dans les injections d’ARNm ?
- Les lots correspondant aux points de données jaune, vert et bleu étaient-ils d'une manière ou d'une autre qualitativement ou quantitativement différents ?
- Le stockage/la manutention après fabrication ont-ils été compromis au niveau de l'installation d'administration (ou ailleurs le long de la chaîne d'approvisionnement), entraînant une variabilité du produit ?
- Quel est le taux Sigma/erreur de ce produit et d'autres produits provenant de l'usine de fabrication/du chef d'équipe en charge de la fabrication ?
- Les ingrédients de ces produits à ARNm Covid provenaient-ils d’Inde ou de Chine plutôt qu’ailleurs, selon le lot ?
- Quels pourcentages de lots de produits à ARNm Covid ont été testés via une collecte en personne par un inspecteur de la FDA plutôt que par « envoi par la poste » depuis leur création jusqu'à ce jour ? Chaque lot a-t-il été testé en utilisant uniquement l'une ou l'autre de ces deux méthodes de collecte ?
- La FDA a-t-elle effectué une vérification des tests de libération sur les lots du système danois de déclaration des événements indésirables DKMA ? Si oui, pourquoi la FDA ne publie-t-elle pas ces résultats de tests particuliers ? Si non, pourquoi les tests n’ont-ils pas été effectués ?
- Existe-t-il un problème fondamental lié à la production cohérente de LNP et/ou de séquences d’ARNm de manière fiable et sans contamination ?
Les résultats de l'étude danoise et les questions ci-dessus concernant les événements indésirables pourraient *commencer* à être abordés, mais pas sans que la FDA partage indépendamment les résultats de ses tests de libération. Dans l’état actuel des choses, en raison des expurgations omniprésentes de la FDA (b)(4), personne ne connaît la méthodologie validée pour tester les injections d’ARNm de Covid. or quels lots exactement de l'étude danoise ont été ou n'ont pas été testés or les résultats de ces tests par lots.
… Là encore, même si la FDA avait choisi de publier les résultats de ces tests par lots, comment les consommateurs peuvent-ils savoir si ces résultats sont représentatifs des lots spécifiés, puisque les fabricants sélectionnent eux-mêmes les échantillons à « envoyer par courrier ? »
Ne pas assurer la transparence des ingrédients et garantir la qualité via une méthodologie d'échantillonnage appropriée est une exigence fondamentale et fondamentale de la FDA. En fait, c’est la principale raison de la création de la FDA ! Les Américains ne méritent-ils pas une meilleure transparence, une meilleure surveillance et des lois sur un « étiquetage véridique » lorsqu’il s’agit de nos produits pharmaceutiques – d’autant plus que ces lois ont été adoptées il y a plus de 100 ans ?
Publié sous un Licence internationale Creative Commons Attribution 4.0
Pour les réimpressions, veuillez rétablir le lien canonique vers l'original Institut Brownstone Article et auteur.









