Rappelez-vous quand il y avait panique en 2020 parce que le vaccin à ARNm Covid-19 de Pfizer ne pouvait pas être transporté à travers le pays à moins qu’il ne soit stocké à des températures ultra-glaciales ?
Pfizer a déclaré que l'ARNm du vaccin, qui codait pour la protéine de pointe, était instable et se décomposerait si les flacons non ouverts n'étaient pas conservés à -70 °C.
Ainsi, lorsque la FDA a accordé autorisation en décembre 2020, il a précisé que le vaccin devait être conservé entre -80 °C et -60 °C, ce qui nécessitait des congélateurs spéciaux ultra-froids, ce qui s'avérait difficile pour les zones aux ressources limitées.
Mais en février 2021, Pfizer avait apparemment résolu le problème.
Il a soumis de nouveaux «Données de stabilité de l'ARN» à la FDA, démontrant que le vaccin pouvait être conservé dans des congélateurs conventionnels (-20 °C) et ne nécessitait plus de congélateurs ultra-froids.
La FDA , le changement rapidement.
Deux mois plus tard, la Therapeutic Goods Administration (TGA) australienne a également , L’application de Pfizer, permettant de conserver les flacons non ouverts à -20 °C jusqu’à 2 semaines.
La température de stockage n’était pas le seul changement. Les régulateurs pharmaceutiques ont également approuvé la prolongation des dates d’expiration des vaccins.
Par exemple, plusieurs lots du vaccin Pfizer ont vu leur date de péremption prolongée d’un an. (FDA) ou 6 mois (TGA).
Mais étant donné la sensibilité de l’ARN aux changements de température et de durée de stockage, sur quelles données de stabilité les régulateurs se sont-ils appuyés pour donner leur feu vert à ces décisions ?
Frapper un mur de briques
J’ai demandé à la FDA les « données sur la stabilité de l’ARN » qu’elle a reçues de Pfizer, mais l’agence a répondu qu’elle ne fournirait pas ces informations.
Au lieu de cela, la FDA m'a demandé de soumettre une demande d'accès à l'information (FOI).
Je me suis plaint à la FDA que son processus de FOI avait stagné et que j'avais déjà soumis une FOI il y a plus de 6 mois qui était toujours en cours de « traitement », mais en vain.
De même, j'ai demandé les données à la TGA, mais l'agence a répondu : "TGA n'est pas en mesure de fournir ces informations directement car elles sont considérées comme commerciales et confidentielles par les sponsors."
Et qu’en est-il de Pfizer ? J'ai reçu la même réponse. La société a refusé de divulguer les données, affirmant qu’elles étaient « commerciales et confidentielles ».
Phillip Altman a plus de 40 ans d’expérience dans les essais cliniques et les affaires réglementaires, et affirme que les données sur la stabilité de l’ARN sont d’un grand intérêt public et devraient être divulguées.

"Il est extrêmement important de connaître la stabilité de l'ARN dans les vaccins, car si l'ARN se désintègre, l'efficacité du vaccin diminue", explique Altman.
"Mais ma préoccupation concerne davantage la sécurité, car certaines personnes recevront des doses d'ARNm plus élevées que d'autres, ce qui pourrait expliquer pourquoi certains lots de vaccin sont associés à plus d'événements indésirables que d'autres", ajoute-t-il.
Altman souligne une analyse danoise publié dans l' Journal européen d'investigation clinique qui ont révélé que les événements indésirables graves étaient fortement associés à des lots particuliers du vaccin Covid-19 de Pfizer (voir graphique).
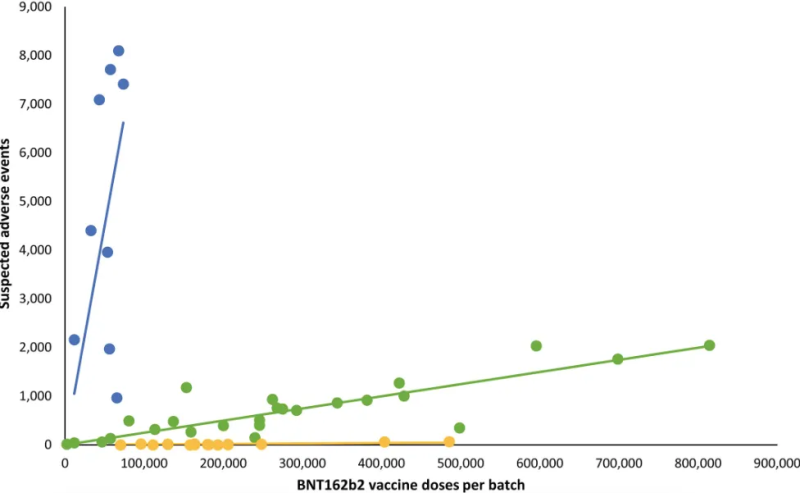
David Wiseman, un doctorant en bioscientifique impliqué dans le développement de produits médicaux, affirme que ce n'est pas seulement « l'ARN intact » dont nous devrions nous préoccuper.
"Nous devons connaître les fragments d'ARN qui ne sont pas intacts", explique Wiseman. "Il est possible que de petits fragments d'ARNm aient également des effets biologiques tels que l'inflammation ou le contrôle du fonctionnement d'autres ARN."

Wiseman dit que ce n’est pas la première fois que les régulateurs prennent une décision qui pourrait avoir un impact sur la stabilité de l’ARN, se référant aux recommandations de la FDA. approbation pour permettre un changement dans la solution tampon utilisée dans le vaccin à ARNm de Pfizer, affirmant que cela « améliorait le profil de stabilité du vaccin ».
« Si le nouveau tampon aidait à stabiliser l’ARNm, il aurait probablement un impact sur la quantité de protéine de pointe produite ou modifierait le comportement des nanoparticules lipidiques dans le corps. Mais où étaient les données lorsque la FDA a pris cette décision ? La FDA n’a jamais insisté pour que la nouvelle formulation soit testée, du moins sur des animaux, avant de l’injecter à des enfants », explique Wiseman.
Il l'a signalé au CDC en Octobre 2021. Depuis, Moderna a publié recherche démontrant comment le changement de tampon modifie non seulement le fonctionnement de l’ARNm, mais aussi comment il influence la stabilité de l’ARN.
Compte tenu des problèmes de stabilité connus, Wiseman affirme qu’il aurait été essentiel d’effectuer des tests de stabilité dans des conditions réelles pour évaluer l’intégrité de l’ARN et des nanoparticules lipidiques après le transport, le stockage, la préparation et le maintien en clinique dans des conditions non idéales.
« Il est temps que les régulateurs rétablissent la confiance du public et publient ce type de données. D’ici là, pourquoi devrions-nous injecter un vaccin à quiconque, en particulier aux enfants, sans divulguer ces données, ainsi que d’autres types de données ? dit Wiseman.
Réédité de l'auteur Sous-empilement
Publié sous un Licence internationale Creative Commons Attribution 4.0
Pour les réimpressions, veuillez rétablir le lien canonique vers l'original Institut Brownstone Article et auteur.









