In première partie de cet article, j'ai passé en revue le cadre contractuel et réglementaire appliqué par le gouvernement américain au développement initial, à la fabrication et à l'acquisition des injections d'ARNm Covid, en utilisant les accords BioNTech/Pfizer pour illustrer le processus.
J'ai montré qu'une autorisation d'utilisation d'urgence (EUA) était accordée à ces produits sur la base d'essais cliniques et de processus de fabrication menés avec
- pas de normes juridiques contraignantes,
- aucune surveillance ou réglementation de sécurité légalement interdite, et
- aucune réparation légale de la part du fabricant pour les dommages potentiels.
Dans cet article de suivi, je fournirai une analyse détaillée de la documentation sous-jacente.
Autre autorisation/accord de transaction (OTA) : une voie d'acquisition militaire
Les accord entre le gouvernement américain, représenté par le ministère de la Défense (DoD), et Pfizer, représentant le partenariat BioNTech/Pfizer, en juillet 2020, pour l'achat d'un « vaccin pour prévenir le COVID-19 » n'était pas un contrat d'acquisition ordinaire.
Il s’agissait d’un accord sous Other Transaction Authority (OTA) – une voie d’acquisition qui, selon Directives du ministère de la Défense, est utilisé depuis 1958 pour « permettre à une agence fédérale de conclure des transactions autres que les contrats, les subventions ou les accords de coopération. »
[FACE EN GRAS AJOUTÉ]
Un examen approfondi de l'utilisation de l'OTA par le DoD, y compris son historique statutaire, peut être trouvé dans le Rapport du Congressional Research Service du 22 février 2019. Ce rapport, ainsi que toutes les autres discussions sur l'OTA, précise qu'il s'agit d'une voie d'acquisition alternative. à des fins de défense et militaires. Il n’est pas destiné, et n’a jamais été utilisé avant Covid, à quoi que ce soit destiné principalement à un usage civil.
Si vous cherchez Lois OTA dans le Code américain, voici le chemin que vous emprunterez :
Forces armées -> Droit militaire général -> Acquisition -> Recherche et ingénierie -> Accords -> Autorité du DoD pour réaliser certains projets prototypes
Ce parcours juridique montre très clairement que les lois OTA sont destinées à l'acquisition de prototypes de recherche et d'ingénierie pour les forces armées.
Selon le site Internet de la DARPA,
Le ministère de la Défense est compétent pour trois types différents d'OT : (1) les OT de recherche, (2) les OT de prototype et (3) les OT de production.
Ces trois types d'OT représentent trois étapes de recherche initiale, de développement d'un prototype et de production éventuelle.
Au sein de ces trois types, il existe des catégories spécifiques de projets auxquels OTA peut postuler :
- A l'origine, selon le Vue d'ensemble de l'OTA fournie par le DoD, l’autre autorisation de transaction était « limitée à s’appliquer aux armes ou aux systèmes d’armes dont l’acquisition ou le développement était proposé par le DoD ».
- L’OTA a ensuite été élargi pour inclure « tout projet prototype directement lié à l’amélioration de l’efficacité des missions du personnel militaire et des plates-formes, systèmes, composants ou matériaux de soutien proposés pour être acquis ou développés par le DoD, ou à l’amélioration des plates-formes, systèmes, composants. , ou des matériaux utilisés par les forces armées.
Jusqu’à présent, rien de tout cela ne ressemble à une voie d’acquisition de millions de nouveaux produits médicaux destinés principalement à un usage civil.
Existe-t-il une exception pour l’utilisation civile de l’OTA qui pourrait s’appliquer aux vaccins Covid à ARNm ?
Les Loi sur l'autorisation de la défense nationale pour l'exercice 2004 (P.L. 108-136) contenait une section qui donnait d'autres pouvoirs de transaction au « chef d'une agence exécutive qui s'engage dans des projets de recherche fondamentale, de recherche appliquée, de recherche avancée et de développement » qui « ont le potentiel de faciliter la défense ou le rétablissement contre le terrorisme ou les armes nucléaires, biologiques, attaque chimique ou radiologique.
Cette disposition a été prolongée jusqu’en 2018, mais ne semble pas avoir été prolongée au-delà de cette année. Notez également que même dans ce cas exceptionnel d'utilisation de l'OTA par un non-DoD, la situation doit impliquer du terrorisme ou une attaque avec des armes de destruction massive (CBRN).
Quelles autres lois OTA pourraient s’appliquer ?
Le rapport CRS 2019 cité ci-dessus fournit ce graphique, montrant que quelques agences non-DoD disposent d'une OTA ou d'autorités connexes :
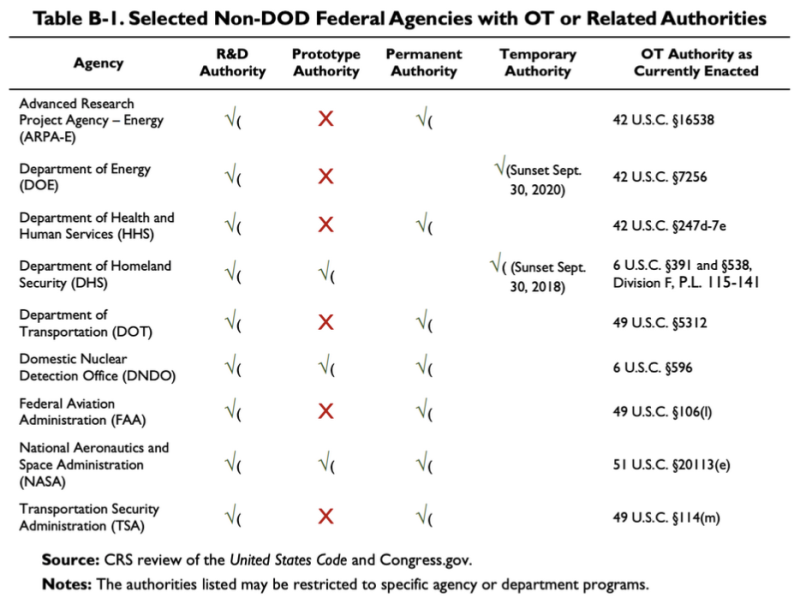
Selon ce tableau, le ministère de la Santé et des Services sociaux (HHS) dispose d'autres autorisations de transaction en matière de recherche et développement (R&D). La loi relative au L'autorité OT du HHS est 42 U.S.C. §247d-7e.
Où se trouve cette loi et que dit-elle ?
Santé publique et protection sociale -> Service de santé publique -> Pouvoirs et devoirs généraux -> Coopération fédérale-État -> Autorité de recherche et de développement biomédical avancé (BARDA) -> Autorités de transaction
Il existe donc un endroit dans le droit relatif à la santé et au bien-être des civils où l'OTA pourrait être applicable, même si elle est valide. uniquement pour la recherche et le développement, pas pour les prototypes ou la fabrication.
La loi stipule que le secrétaire de la BARDA a l'autorité d'OT
à l'égard d'un produit qui est ou pourrait devenir un contre-mesure qualifiée ou produit qualifié de pandémie ou d'épidémie, des activités qui principalement...
(i) sont menées après la recherche fondamentale et le développement préclinique du produit ; et
(ii) sont liés à la fabrication du produit à l’échelle commerciale et sous une forme qui satisfait aux exigences réglementaires de la loi fédérale Loi sur les aliments, les drogues et les cosmétiques [21 USC 301 et suiv.] ou sous article 262 de ce titre.
[FACE EN GRAS AJOUTÉ]
Les « exigences réglementaires » énumérées dans la loi signifient qu’il serait impossible pour BARDA/HHS de conclure des accords – même simplement de R&D – pour des produits médicaux (comme les vaccins à ARNm) qui n’auraient pas été soumis à des tests de sécurité rigoureux et à une surveillance stricte de la fabrication.
Le « partenariat » du HHS avec le DoD a contourné les lois sur la protection civile
Pour résumer la situation difficile des autres autorisations/accords de transaction concernant les autorités civiles, en général, et les vaccins à ARNm Covid, en particulier :
- L’OTA a été écrite et codifiée comme un moyen permettant aux militaires d’acquérir des armes et d’autres systèmes et équipements nécessaires sans trop de bureaucratie. Il couvre la recherche et le développement, les prototypes et la fabrication ultérieure.
- La seule OTA pour une agence de santé publique concerne le HHS et couvre uniquement la recherche et le développement, pas les prototypes ou la fabrication.
- Même l’OTA R&D accordée au HHS exige toujours que les produits soient fabriqués « sous une forme qui satisfait aux exigences réglementaires » en matière de sécurité des médicaments et des vaccins.
En d’autres termes : le HHS n’aurait en aucun cas pu utiliser son OTA très limitée pour signer des contrats pour des centaines de millions de nouveaux produits médicaux.
Alors, qu’a fait le HHS ?
Comme l’a noté le Government Accountability Office (GAO) dans son Rapport de juillet 2021 sur « Contrats Covid-19 : » Le HHS s’est « associé » au DoD pour « tirer parti des autorités OTA du DoD… ce qui manquait au HHS ». (P. 24)
Quelles sont les autorités OT du DoD pour les produits médicaux ?
Comme nous l’avons vu, l’OTA vise à aider les militaires à obtenir des équipements et des technologies sans trop de tracas bureaucratiques. Aucune des lois originales relatives à l’OTA ne mentionnait autre chose que des « plates-formes, systèmes, composants ou matériaux » destinés à « améliorer l’efficacité des missions du personnel militaire ».
Mais cinq ans avant le Covid, un usage exceptionnel de l’OTA avait été introduit :
En 2015, Le DoD a annoncé la création du CBRN Medical Countermeasure Consortium, dont le but était d’utiliser la voie d’acquisition de l’OTA pour « travailler avec le DoD pour développer des contre-mesures médicales chimiques, biologiques, radiologiques et nucléaires autorisées par la FDA ». [FDA = Administration des aliments et des médicaments]
Comme décrit dans l’annonce de 2015, cela comprenait « des technologies prototypes pour des contre-mesures médicales thérapeutiques ciblant des cibles de toxines virales, bactériennes et biologiques présentant un intérêt pour le DoD ». La liste des agents comprenait les principaux agents pathogènes de guerre biologique, tels que l'anthrax, l'Ebola et le Marburg.
L’annonce précise ensuite que « les technologies habilitantes peuvent inclure des modèles animaux de maladies et de pathogenèses virales, bactériennes ou biologiques (voies d’exposition multiples), des tests, des technologies de diagnostic ou d’autres technologies de plate-forme qui peuvent être appliquées au développement de MCM approuvés ou autorisés. [contre-mesures médicales]. »
Bien que cela ne ressemble toujours pas à la production de 100 millions de nouveaux vaccins à usage civil, cela laisse plus de latitude à l’OTA que l’autorité très limitée d’autres transactions accordée au HHS.
Alors que l'OTA du HHS exige le respect de réglementations approfondies en matière de développement et de fabrication, la voie OTA permettant au DoD de développer des contre-mesures médicales ne nécessite qu'une « licence FDA ».
Ainsi, en utilisant d'autres autorités de transaction du DoD, il serait théoriquement possible de contourner toute réglementation de sécurité – en fonction des exigences d'autorisation de la FDA pour un produit généré par l'OTA. Comme nous le verrons, dans le cas des vaccins Covid à ARNm, une autorisation d’utilisation d’urgence a été accordée, ne nécessitant aucune surveillance légale en matière de sécurité.
Autorisation d'utilisation d'urgence (EUA)
Voici comment la Food & Drug Administration (FDA) décrit ses pouvoirs EUA:
Article 564 de la loi FD&C (21 USC 360bbb-3) permet à la FDA de renforcer les protections de santé publique contre les agents biologiques, chimiques, nucléaires et radiologiques.
Grâce à cette autorité EUA, la FDA peut contribuer à garantir que des contre-mesures médicales peuvent être utilisées en cas d'urgence pour diagnostiquer, traiter ou prévenir des maladies ou affections graves ou potentiellement mortelles causées par des agents biologiques, chimiques, nucléaires ou radiologiques lorsqu'il n'existe pas de mesures adéquates et approuvées. , et les alternatives disponibles (entre autres critères).
Il est extrêmement important de comprendre que ces pouvoirs EUA ont été accordés en 2004 dans des circonstances très spécifiques liées à la préparation à des attaques par armes de destruction massive, autrement connues sous le nom d’agents CBRN (chimiques, biologiques, radiologiques, nucléaires).
Comme expliqué dans le Bill of Health de Harvard Law,
En fin de compte, c’est la guerre contre le terrorisme qui donnera lieu à une autorisation d’utilisation d’urgence. Après les événements du 11 septembre 2001 et les attaques ultérieures par courrier à l'anthrax, le Congrès a adopté la Loi sur le projet Bioshield de 2004. La loi prévoyait des milliards de dollars de crédits pour l’achat de vaccins en prévision d’une attaque bioterroriste et pour la constitution de stocks de contre-mesures d’urgence. Afin de pouvoir agir rapidement en cas d'urgence, le Congrès a autorisé la FDA à autoriser l'utilisation d'urgence de produits formellement non approuvés contre une menace pour la santé et la sécurité publiques (sous réserve d'une déclaration d'urgence par le HHS). Le record indique que le Congrès se concentrait spécifiquement sur la menace de bioterrorisme, et non sur la préparation à une pandémie naturelle.
Les rédaction de la loi EUA souligne le fait qu'il était destiné à être utilisé dans des situations impliquant des armes de destruction massive. Voici les 4 situations dans lesquelles l’EUA peut être délivré :
- une détermination du secrétaire à la Sécurité intérieure selon laquelle il existe une urgence nationale, ou un potentiel important d'urgence nationale, impliquant un risque accru d'attaque avec un ou plusieurs agents biologiques, chimiques, radiologiques ou nucléaires ;
- une détermination du secrétaire à la Défense selon laquelle il existe une urgence militaire, ou un potentiel important d'urgence militaire, impliquant un risque accru pour les États-Unis États les forces militaires, y compris le personnel opérant sous l'autorité du titre 10 ou du titre 50, d'attaquer avec :
- un ou plusieurs agents biologiques, chimiques, radiologiques ou nucléaires ; ou
- un ou plusieurs agents susceptibles de causer, ou qui sont autrement associés à, un risque spécifique et potentiellement mortel pour United États forces armées;
- une détermination par le Secrétaire qu'il existe une urgence de santé publique, ou un potentiel important d'urgence de santé publique, qui affecte, ou est susceptible d'affecter de manière significative, la sécurité nationale ou la santé et la sécurité des États-Unis États les citoyens vivant à l’étranger et qui implique un ou plusieurs agents biologiques, chimiques, radiologiques ou nucléaires, ou une maladie ou une affection pouvant être imputable à ce ou ces agents ; ou
- l’identification d’une menace matérielle en application de l’article 319F-2 du Loi sur le service de santé publique [42 U.S.C. 247d-6b] suffisant pour affecter la sécurité nationale ou la santé et la sécurité des États-Unis États citoyens résidant à l’étranger.
Nulle part dans ces quatre situations il n’est fait mention d’une épidémie, d’une pandémie ou de tout autre type de situation de santé publique d’origine naturelle qui n’est pas causée par « des agents biologiques, chimiques, radiologiques ou nucléaires ».
Le SRAS-CoV-2 pourrait-il être considéré comme un tel agent ?
Si vous cherchez la définition de «agents biologiques» dans le Code juridique américain, vous emprunterez le chemin suivant :
Crimes et procédure pénale -> Crimes -> Armes biologiques -> Définitions
Ainsi, dans le contexte de la loi américaine, le terme « agents biologiques » désigne des armes biologiques, et l’utilisation de tels agents/armes est considérée comme un crime.
Wikipédia fournit ceci définition:
Un agent biologique (également appelé bio-agent, agent de menace biologique, agent de guerre biologique, arme biologique ou arme biologique) est un bactérie, virus, protozoaire, parasite, fongus, ou une toxine qui peut être utilisée à dessein comme une arme dans bioterrorisme or guerre biologique (PC).
Sur quelle base juridique l’EUA a-t-elle été délivrée pour les vaccins à ARNm Covid ?
Il semblerait, sur la base des lois concernant l'EUA, qu'aucune des quatre situations possibles décrites dans la loi ne pourrait s'appliquer à un produit destiné à prévenir ou à traiter une maladie causée par un agent pathogène naturel.
Néanmoins, cette loi a été utilisée pour autoriser les vaccins à ARNm Covid.
Compte tenu des quatre choix énumérés dans la loi EUA, celui qui a été utilisé pour les « contre-mesures » Covid était
C) une détermination par le Secrétaire qu'il existe une urgence de santé publique, ou un potentiel important d'urgence de santé publique, qui affecte, ou est susceptible d'affecter de manière significative, la sécurité nationale ou la santé et la sécurité des États-Unis États citoyens vivant à l’étranger, et qui implique un ou plusieurs agents biologiques, chimiques, radiologiques ou nucléaires, ou une maladie ou une affection pouvant être imputable à ce ou ces agents.
Quand appliqué spécifiquement au Covid, voici comment cela a été formulé :
le secrétaire du ministère de la Santé et des Services sociaux (HHS) a déterminé qu'il existe une urgence de santé publique susceptible d'affecter la sécurité nationale ou la santé et la sécurité des citoyens américains vivant à l'étranger, et qui implique le virus à l'origine du coronavirus Maladie 2019 (COVID-19)…
Il ne fait aucun doute ici que « le virus qui cause le COVID-19 » est considéré comme l’équivalent d’« un ou plusieurs agents biologiques, chimiques, radiologiques ou nucléaires ».
Il est également important de noter que la « détermination d’une urgence de santé publique » de l’EUA est complètement distincte et ne dépend en aucun cas de toute autre déclaration d’urgence de santé publique, comme celles faites par l’OMS, le gouvernement américain. , et le Président au début de la pandémie de Covid-19.
Ainsi, même lorsque l’OMS, le gouvernement américain et le président déclarent que la pandémie est terminée, une autorisation d’utilisation d’urgence peut toujours être accordée si le secrétaire du HHS continue de prétendre que la situation décrite dans la section C) existe.
En regardant tous les EUA pour des centaines de produits médicaux liés au Covid, il est très difficile de voir comment le secrétaire du HHS pourrait justifier l’affirmation selon laquelle « il existe une urgence de santé publique susceptible d’affecter de manière significative la sécurité nationale ou la santé et la sécurité des citoyens américains vivant à l’étranger » dans la plupart, sinon la totalité, des États-Unis. de ces cas.
« Critères statutaires » supplémentaires permettant à la FDA d'accorder une autorisation d'utilisation d'urgence
Une fois que le secrétaire du HHS déclare qu'il existe une urgence de santé publique qui justifie l'EUA, sur la base de l'une des quatre situations énumérées dans la loi, quatre autres « critères statutaires » doivent être remplis pour que la FDA puisse délivrer l'EUA. . Voici comment la FDA explique ces exigences:
- Maladie ou affection grave ou potentiellement mortelle
Pour que la FDA délivre une EUA, le ou les agents CBRN mentionnés dans la déclaration EUA du secrétaire du HHS doivent être capables de provoquer une maladie ou un état grave ou potentiellement mortel.
REMARQUE : Ce critère reprend la spécification d'un agent CBRN, qui est légalement défini comme une arme utilisée pour commettre un crime.
- Preuve d'efficacité
Les produits médicaux qui peuvent être pris en compte pour une EUA sont ceux qui « peuvent être efficaces » pour prévenir, diagnostiquer ou traiter des maladies ou affections graves ou potentiellement mortelles qui peuvent être causées par un ou plusieurs agents CBRN identifiés dans la déclaration du secrétaire du HHS. urgence ou menace d’urgence en vertu de l’article 564(b).
La norme « peut être efficace » pour les EUA fournit un niveau de preuve inférieur à la norme « d'efficacité » utilisée par la FDA pour l'approbation des produits. La FDA a l'intention d'évaluer l'efficacité potentielle d'un éventuel produit EUA au cas par cas à l'aide d'une analyse risques-avantages, comme expliqué ci-dessous.
[FACE EN GRAS AJOUTÉ]
QUESTION JURIDIQUE : Comment quelqu'un peut-il légalement prétendre qu'un produit autorisé en vertu de l'EUA est « sûr et efficace » si la norme légale pour l'EUA est « peut être efficace » et que la FDA déclare qu'il s'agit d'un « niveau de preuve inférieur » à la norme utilisée. pour des approbations de produits régulières ?
- Analyse risques-avantages
Un produit peut être pris en considération pour une EUA si le commissaire détermine que les avantages connus et potentiels du produit, lorsqu'il est utilisé pour diagnostiquer, prévenir ou traiter la maladie ou l'affection identifiée, l'emportent sur les risques connus et potentiels du produit.
Pour déterminer si les avantages connus et potentiels du produit l'emportent sur les risques connus et potentiels, la FDA a l'intention de regarder à l'ensemble des preuves scientifiques pour établir une détermination globale des risques et des avantages. Une telle preuve, qui pourrait survenir provenant de diverses sources, Peut inclure (sans s'y limiter) : résultats d'essais cliniques nationaux et étrangers, données d'efficacité in vivo provenant de modèles animaux et données in vitro, disponible pour examen par la FDA. La FDA évaluera également la qualité et la quantité des preuves disponibles, compte tenu de l’état actuel des connaissances scientifiques.
[FACE EN GRAS AJOUTÉ]
NOTE JURIDIQUE : Il n’existe aucune norme juridique ni aucune définition juridique de ce que signifie « les avantages connus et potentiels » qui l’emportent sur les « risques connus et potentiels ». Il n’existe pas non plus de définition juridique qualitative ou quantitative de ce qui constitue des « preuves disponibles » acceptables sur lesquelles l’analyse risques-avantages « peut être » fondée. Il pourrait n’y avoir aucune preuve réelle, mais la conviction qu’un produit présente de nombreux avantages potentiels et peu de risques potentiels, ce qui satisferait à cette « exigence légale ».
- Aucune alternative
Pour que la FDA délivre une EUA, il ne doit exister aucune alternative adéquate, approuvée et disponible au produit candidat pour diagnostiquer, prévenir ou traiter la maladie ou l'affection. Un produit alternatif potentiel peut être considéré comme « indisponible » si les stocks de l’alternative approuvée sont insuffisants pour répondre pleinement aux besoins d’urgence.
QUESTION JURIDIQUE : Mis à part la diffamation/interdiction flagrante et potentiellement criminelle des traitements alternatifs contre le Covid-19 comme l'ivermectine et l'hydroxychloroquine, à quel moment existe-t-il une alternative approuvée pour « prévenir le Covid-19 » (la seule chose pour laquelle les vaccins à ARNm ont été achetés ? ) – Paxlovid, par exemple – qui rendrait illégale une EUA pour les vaccins à ARNm ?
Voici comment tous ces « critères statutaires » ont été satisfaits dans la réalité. Autorisation d'utilisation d'urgence pour les vaccins à ARNm BioNTEch/Pfizer Covid:
J'ai conclu que l'utilisation d'urgence du vaccin Pfizer-BioNTech contre la COVID‑19 pour la prévention de la COVID‑19 lorsqu'il est administré comme décrit dans la portée de l'autorisation (section II) répond aux critères de délivrance d'une autorisation en vertu de l'article 564(c) de la la Loi, parce que :
- Le SRAS-CoV-2 peut provoquer une maladie ou une affection grave, voire mortelle, y compris une maladie respiratoire grave, chez les humains infectés par ce virus ;
- Sur la base de l’ensemble des preuves scientifiques dont dispose la FDA, il est raisonnable de croire que le vaccin Pfizer-BioNTech contre la COVID‑19 peut être efficace pour prévenir le COVID-19, et que, lorsqu'il est utilisé dans les conditions décrites dans la présente autorisation, les bénéfices connus et potentiels du vaccin Pfizer-BioNTech contre la COVID‑19 lorsqu'il est utilisé pour prévenir le COVID-19 l’emportent sur ses risques connus et potentiels ; et
- Il n’existe aucune alternative adéquate, approuvée et disponible à l’utilisation d’urgence du vaccin Pfizer-BioNTech contre la COVID‑19. pour prévenir le COVID-19.
[FACE EN GRAS AJOUTÉ]
REMARQUE : Le seul contexte dans lequel la FDA a évalué les avantages et les risques potentiels du vaccin et dans lequel elle a déterminé qu'il « pouvait être efficace » était dans la prévention du Covid-19.
Il n'y a aucune considération, aucune preuve d'un bénéfice réel ou potentiel, et aucune détermination quant à l'efficacité potentielle du vaccin pour faire autre chose, notamment : réduire le risque de maladie grave, réduire le risque d'hospitalisation, réduire le risque de décès. , réduisant ainsi le risque de toute condition réellement ou potentiellement liée au Covid-19.
PAR CONSÉQUENT, on pourrait raisonnablement remettre en question la légalité de toute affirmation selon laquelle le vaccin est « sûr et efficace » dans un contexte autre que « lorsqu’il est utilisé pour prévenir le COVID-19 » – ce que les vaccins étaient connus pour NE PAS FAIRE très peu de temps après avoir été commercialisés. introduit.
Si l’on disait aux gens que les vaccins à ARNm de BioNTech/Pfizer sont « sûrs et efficaces » pour autre chose que la prévention du Covid-19, et s’ils étaient menacés de conséquences s’ils ne prenaient pas le vaccin pour autre chose que la prévention du Covid-19, pourraient-ils ont-ils un argument légitime selon lequel ils ont été illégalement contraints d'accepter un produit non approuvé sous des allégations frauduleuses ?
Exigences de troisième niveau pour l'EUA pour les produits non approuvés
Une fois que nous aurons la déclaration d'urgence spécifique à l'EUA, et une fois que la FDA aura déclaré que le produit peut être efficace et que toutes les preuves disponibles (de zéro à l'infini) montrent que ses avantages l'emportent sur ses risques (tels que déterminés par ce que la FDA pense que ceux-ci pourraient être), il existe un niveau supplémentaire de réglementation non liée à la sécurité et à l’efficacité.
Voici comment un Rapport 2018 du Congressional Research Service sur l'EUA explique ceci:
FFDCA §564 ordonne à la FDA d'imposer certaines conditions requises dans un EUA et autorise des conditions discrétionnaires supplémentaires, le cas échéant. Les conditions requises varient selon que l'EUA concerne un produit non approuvé ou une utilisation non approuvée d'un produit approuvé. Pour un produit non homologué, les conditions d’utilisation doivent :
1° s'assurer que les professionnels de la santé qui administrent le produit reçoivent l'information requise;
(2) s'assurer que les personnes à qui le produit est administré reçoivent les informations requises ;
(3) prévoir la surveillance et la déclaration des événements indésirables associés au produit ; et
(4) prévoir la tenue de registres et la production de rapports par le fabricant.
QUESTION JURIDIQUE : Quelles sont exactement les « informations requises » ? Nous savons que les gens ont été informés que les vaccins avaient reçu une autorisation d’utilisation d’urgence. Mais leur a-t-on dit que cela signifie « un niveau de preuve inférieur » à celui requis pour les allégations « sûres et efficaces » sur d’autres produits médicaux ? Ont-ils été informés qu’il existe différents niveaux de « sécurité et efficacité » selon qu’un produit possède une EUA ou un autre type d’autorisation ?
REMARQUE : La loi exige qu'il y ait un moyen de surveiller et de signaler les événements indésirables. Cependant, il n’indique pas qui surveille, quelles sont les normes de reporting et quel est le seuil pour prendre des mesures sur la base des rapports.
EUA comparé à toutes les autres voies d’approbation des médicaments/vaccins
En tant que chercheur/écrivain Sacha Latypova Comme l'a souligné, de nombreuses personnes ont été confuses par EUA, car cela ressemble beaucoup à EAU, qui signifie « Expanded Access Use ». Il s'agit d'un type d'autorisation accordée à des produits médicaux en cas de besoin urgent par un groupe particulier de patients (par exemple, les patients atteints d'un cancer de stade IV dont l'espérance de vie se mesure en mois) qui sont prêts à risquer des événements indésirables, voire la mort, en échange d'un accès. à un traitement expérimental.
L’autorisation d’utilisation d’urgence n’est en aucun cas liée à l’utilisation à accès étendu et ne présente aucune ressemblance avec celle-ci.
Les différentes voies légales d'autorisation des produits médicaux sont soigneusement présentées dans un tableau mis en évidence par un chercheur en droit. Catherine Watt. Le tableau fait partie d’une présentation de 2020 pour une session d’apprentissage conjointe FDA-CDC : Mises à jour réglementaires sur l'utilisation de contre-mesures médicales.
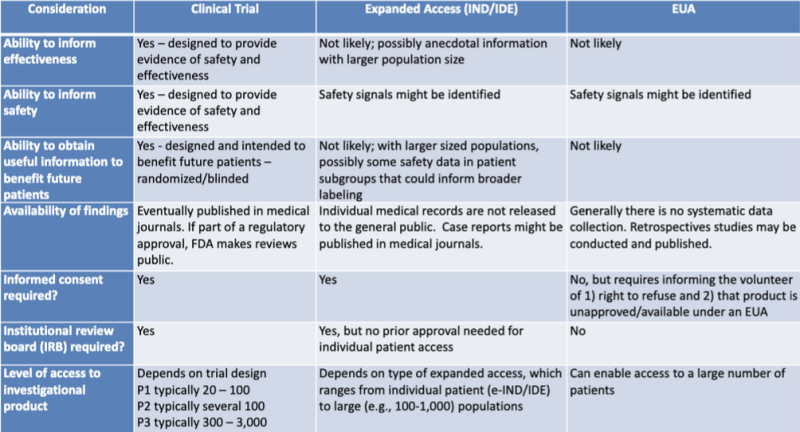
Ce tableau montre très clairement qu'il est peu probable que le processus EUA fournisse des informations sur l'efficacité du produit, qu'il n'est pas conçu pour fournir des preuves de sécurité, qu'il n'est pas susceptible de fournir des informations utiles au bénéfice des futurs patients, qu'il n'implique aucune collecte systématique de données, qu'il ne nécessite aucune étude rétrospective, pas de consentement éclairé et pas de comité d'examen institutionnel.
De plus, dans un 2009 Publication de l'Institut de médecine de la National Academic, également souligné par Watt, intitulé « Medical Countermeasures: Dispensing Emergency Use Authorization and the Postal Model – Workshop Summary », on retrouve cette déclaration à la p. 28 :
Il est important de reconnaître qu’une EUA ne fait pas partie du chemin du développement ; il s'agit d'une entité entièrement distincte qui n'est utilisée qu'en cas d'urgence et ne fait pas partie du processus d'approbation des médicaments.
Cela signifie-t-il que les approbations de contre-mesures contre le Covid-19 basées sur les EUA étaient illégales ? Cela signifie-t-il qu'il n'existe aucun moyen légal de prétendre qu'un produit EUA est « sûr et efficace » parce qu'il ne fait PAS PARTIE DU PROCESSUS D'APPROBATION DES MÉDICAMENTS ?
Conclusion
Il est tout à fait évident, compte tenu de toutes les informations contenues dans cet article et dans le précédent Partie 1, que les vaccins à ARNm BioNTach/Pfizer Covid ont été développés, fabriqués et autorisés en vertu des lois militaires réservées aux situations d'urgence impliquant une guerre biologique/terrorisme, et non à des maladies d'origine naturelle affectant l'ensemble de la population civile.
Par conséquent, le respect des réglementations et la surveillance que nous nous attendons à trouver lorsqu’un produit est jugé « sûr et efficace » pour l’ensemble de la population civile n’étaient pas légalement requis.
Cette analyse peut-elle être utilisée pour contester la légalité de l’affirmation « sûre et efficace » de ces responsables gouvernementaux qui savaient ce qu’impliquait l’EUA ? Y a-t-il d'autres conséquences juridiques ?
Je l'espère.
Il est important de noter que dans les contestations judiciaires intentées jusqu’à présent contre les vaccins à ARNm du Covid, aucune décision n’a été rendue (à ma connaissance) sur la question de savoir si le droit militaire, comme l’OTA et l’EUA, peut être appliqué aux situations civiles. Cependant, il y a eu une déclaration du juge du tribunal de district Michael Truncale, dans son classement sans suite du dossier du lanceur d'alerte Brook Jackson c.Ventavia et Pfizer, il est important de le garder à l'esprit.
Ici, le juge reconnaît que l'accord pour les vaccins à ARNm BioNTech/Pfizer était une OTA militaire, mais il refuse de se prononcer sur son applicabilité aux circonstances non militaires (maladie d'origine naturelle, 100 millions de doses pour la plupart non destinées à un usage militaire) dans lesquelles il a été publiée:
Le fait que le personnel militaire et les civils aient reçu le vaccin n’indique pas que l’acquisition du vaccin n’était pas pertinente pour améliorer l’efficacité de la mission militaire. Plus important encore, Mme Jackson demande en fait à cette Cour d’annuler la décision du DoD d’exercer une autre autorité transactionnelle pour acheter le vaccin de Pfizer. Mais comme la Cour suprême des États-Unis le souligne depuis longtemps, « les décisions complexes, subtiles et professionnelles concernant la composition, la formation, l’équipement et le contrôle d’une force militaire sont essentiellement des jugements militaires professionnels ». Gilligan c.Morgan, 413 U.S. 1, 10 (1973). Ainsi, il est « difficile de concevoir un domaine d’activité gouvernementale dans lequel les tribunaux ont moins de compétence ». Identifiant. Cette Cour n’opposera pas son veto aux jugements du DoD concernant l’efficacité de la mission lors d’une urgence nationale.
Ce n’est là que l’un des nombreux obstacles juridiques qui subsistent dans la bataille visant à interdire finalement tous les produits à ARNm approuvés pendant l’urgence de Covid-19, ainsi que tout produit à ARNm ultérieur dont l’approbation était basée sur le processus d’approbation de Covid-19.
Publié sous un Licence internationale Creative Commons Attribution 4.0
Pour les réimpressions, veuillez rétablir le lien canonique vers l'original Institut Brownstone Article et auteur.









